Роль трансаминирования и трансдезаминирования
Реакциитрансаминирования:
· активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
· обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
· начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
· необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печенидля кетогенеза иглюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
· при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов дляглюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
· является одной из транспортных форм аминного азота в гепатоциты,
· способна реагировать со свободным аммиаком, обезвреживая его.
Процесс трансдезаминирования идет в организме непрерывно, потому что:
· сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки длясинтеза аммонийных солей.
Для трансаминирования необходим витамин В6
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).
В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
· к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
· на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
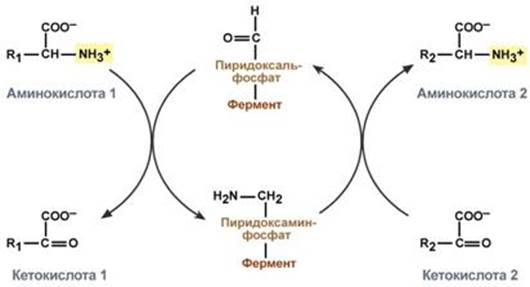
Схема реакции трансаминирования
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованиюкетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
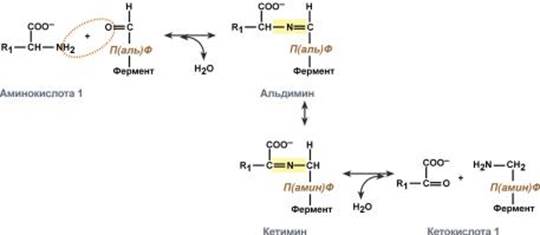
Механизм переноса аминогруппы от аминокислоты на кетокислоту
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
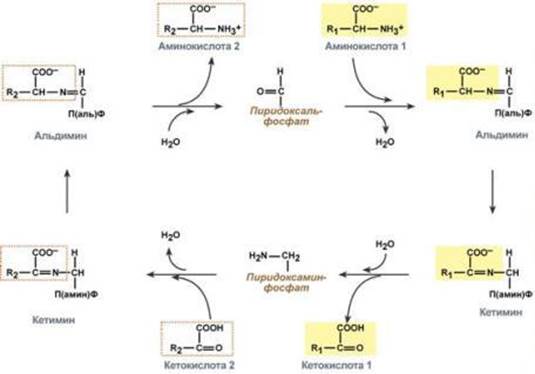
Реакции полного цикла трансаминирования
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
· пировинограднойс образованием аланина,
· щавелевоуксуснойс образованием аспартата,
· α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количествоглутаминовой кислоты.
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Аминотрансферазы имеют клиническое значение
В медицине нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) иаспартатаминотрансферазы (АСТ, АсАТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот.
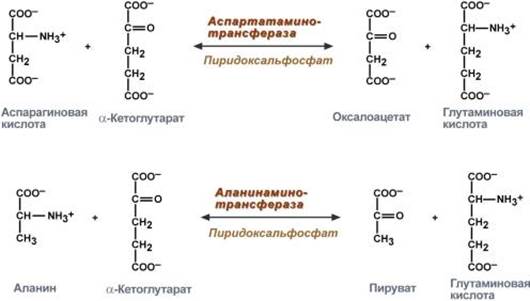
Реакции, катализируемые аланинаминотрансферазой и аспартатаминотрансферазой
Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при нарушении печени (гепатиты различного генеза ) – для АЛТ.
В клинической практике определение активности АЛТ и АСТ используется для дифференциальной диагностики болезней печени и миокарда, глубины поражения и контроля эффективности их лечения.
Креатинфосфат - это запас взрывной энергии
Креатин– вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфатакреатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки.
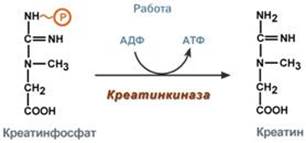
Использование креатинфосфата для ресинтеза АТФ
Особенно показательна роль креатина в мышечной ткани. Креатинфосфат обеспечивает срочный ресинтез АТФ в первые секунды работы (5‑10 сек), когда никакие другие источники энергии (анаэробный гликолиз, аэробное окисление глюкозы, β-окисление жирных кислот) еще не активированы, и кровоснабжение мышцы не увеличено. В клетках нервной ткани креатинфосфат поддерживает жизнеспособность клеток при отсутствии кислорода.
При мышечной работе ионы Са2+, высвободившиеся из саркоплазматического ретикулума, являются активаторами креатинкиназы. Реакция еще интересна тем, что на ее примере можно наблюдать обратную положительную связь — активацию фермента продуктом реакции креатином. Это позволяет избежать снижения скорости реакции по ходу работы, которое должно было бы произойти по закону действующих масс из-за снижения концентрации креатинфосфата в работающих мышцах.
Около 3% креатинфосфата постоянно в реакции неферментативного дефосфорилирования превращается в креатинин. Количество креатинина, выделяемое здоровым человеком в сутки, всегда почти одинаково и зависит только от объема мышечной массы. Уровень активности креатинкиназы в крови и концентрация креатинина в крови и моче являются ценными диагностическими показателями.
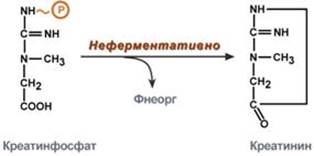
Образование креатинина из креатинфосфата
Синтез креатина идет последовательно в почках и печени в двух трансферазных реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или мозг.
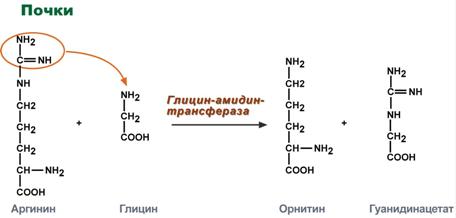
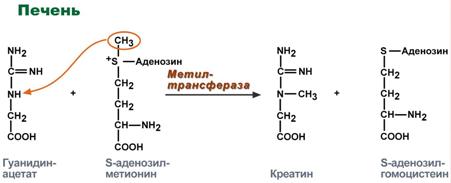
Реакции синтеза креатина в почках и печени
Здесь при наличии энергии АТФ (во время покоя или отдыха) он фосфорилируется с образованием креатинфосфата.
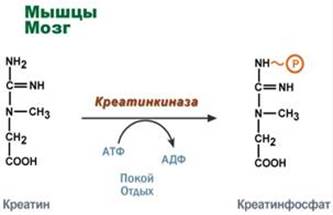
Синтез креатинфосфата
Если синтез креатина опережает возможность его фиксации в мышечной ткани, то развиваетсякреатинурия – появление креатина в моче. Физиологическая креатинурия наблюдается в первые годы жизни ребенка. Иногда к физиологической относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина. При заболеваниях мышечной системы (при миопатии или прогрессирующей мышечной дистрофии) в моче наблюдаются наибольшие концентрации креатина – патологическаякреатинурия.
Дезаминирование аминокислот в мышце отличается от обычного
Так как в скелетных мышцах нет глутаматдегидрогеназы и нет возможности производить прямое дезаминирование аминокислот, то для этого существует особый путь.
В мышечных клетках при интенсивной работе, когда идет распад мышечных белков, активируется альтернативный способ дезаминирования аминокислот – цикл АМФ-ИМФ. Образовавшийся при трансаминировании глутамат при участии аспартатаминотрансферазыреагирует с оксалоацетатом и образуется аспарагиновая кислота. Аспартат далее передает свою аминогруппу на инозинмонофосфат (ИМФ) с образованием АМФ, который в свою очередь подвергается дезаминированию с образованием свободного аммиака.
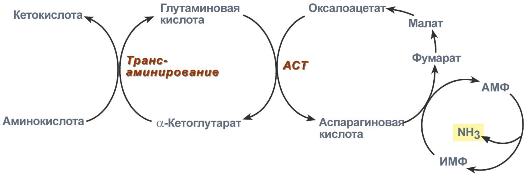
Реакции непрямого дезаминирования аминокислот в мышечной ткани
Процесс носит защитный характер, т.к. при мышечной работе выделяется молочная кислота. Аммиак, связывая ионы Н+, предотвращает закисление цитозоля миоцитов.
Появление аммиака в клетках непрерывно
Аммиак постоянно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными источниками аммиака являются следующие реакции:
· неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени,
· окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
· дезаминирование амидовглутаминовой и аспарагиновой кислот – в печени и почках,
· катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
· жизнедеятельность бактерийтолстого кишечника,
· распад пуриновых и пиримидиновых оснований – во всех тканях.
