Введение ДНК в растения с помощью Ti- и Ri-плазмид
Разработаны два метода для введения Ti-плазмидных последовательностей, содержащих нужный ген, в растение.
Первый метод — метод «промежуточных векторов» (коинтегративных векторов) — основан на использовании плазмиды кишечной палочки pBR 322 (рис. 2).
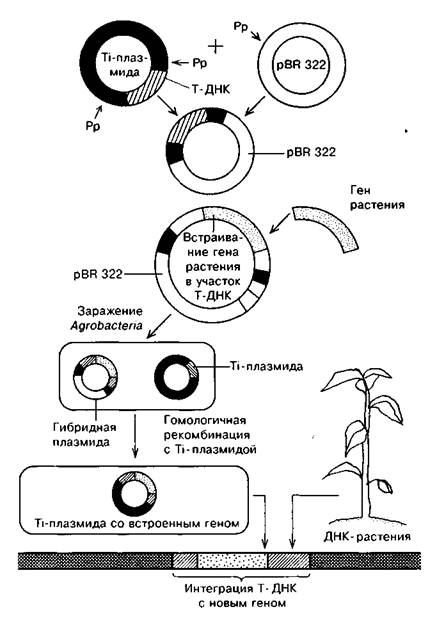
Рис. 2. Создание коинтегративного вектора на основе Тi-плазмиды: Рр - расщепление рестриктазой
Т-ДНК вырезают из Ti-плазмиды с помощью рестриктаз и встраивают в плазмиду pBR 322 для клонирования в Е. соli. Бактерии, содержащие плазмиду с Т-ДНК, размножают, после чего эту плазмиду выделяют. Затем в клонированную Т-ДНК с использованием рестриктаз встраивают нужный ген. Эту рекомбинантную молекулу, содержащую Т-ДНК со встроенным в нее геном, снова размножают в большом количестве, то есть клонируют в кишечной палочке. Затем с помощью конъюгации вводят в клетки агробактерии, несущие полную Ti-плазмиду.
Между Т-сегментами нативной Ti-плазмиды и промежуточного вектора происходит гомологичная рекомбинация. В результате этого Т-ДНК со встроенным геном включается в нативную Ti-плазмиду, замещая нормальную ДНК. Получаются клетки А. tumefaciens, несущие Ti-плазмиды со встроенными в Т-сегмент нужными генами. Далее их перенос в клетки растения осуществляется обычным способом, характерным для агробактерий.
Второй метод основан на создании системы бинарных (двойных) векторов.
Последние исследования показали, что для заражения и трансформации не нужна целая Ti-плазмида, а достаточны только пограничные области Т-ДНК и один участок Ti-плазмиды, ответственный за вирулентность. Причем эти два участка ДНК не обязательно должны находиться в одной и той же плазмиде. Если клетки агробактерий содержат Ti-плазмиду с сегментом vir и другую плазмиду с Т-ДНК, эти бактерии могут трансформировать клетки растений. При этом Т-ДНК с любыми встроенными в нее генами интегрирует с геномом растения, для этого не нужна гомологичная рекомбинация в бактериальных клетках. Для осуществления экспрессии чужеродных генов, нужен специфический промотор из Т-ДНК, например, промотор нопалинсинтетазы.
Показано, что он функционирует в клетках растений и может быть легко соединен с кодирующей последовательностью чужеродного гена в широко распространенных субклонах Ti-плазмид. Другое преимущество данного промотора заключается в том, что он функционирует в каллусах и в большинстве органов растений. Эффективность трансформации с помощью модифицированной Т-ДНК агробактерий превосходит на сегодняшний день все другие способы переноса генов в растение.
О механизмах, с помощью которых агробактерия переносит Т-ДНК ядра растений, известно очень мало: Т-сегменты ДНК октопиновых и нопалиновых плазмид встраиваются в разные, по-видимому случайные, точки хромосом хозяина, но при этом они никогда не интегрируют с ДНК митохондрий и хлоропластов.
Для введения сконструированных Ti-плазмид в растительную клетку может быть использовано несколько методов. Наиболее простой из них природный способ — это инокуляция сконструированных штаммов в поврежденные (пораненные) области растения.
Другой метод состоит в трансформации протопластов путем кокультивирования их с агробактериями Методика кокультивации может рассматриваться как индукция опухолей в искусственных условиях: вирулентные агробактерии временно совместно культивируются с протопластами. Если агробактерии добавляются к свежевыделенным или однодневным протопластам, не наблюдается ни присоединения бактерий, ни трансформации. Существенным условием для трансформации является наличие вновь образуемых клеточных стенок у 3-дневных протопластов. Это подтверждается применением ингибиторов образования клеточной стенки, которые ингибируют и присоединение бактерий. После периода кокультивации (более суток), в течение которого наступает агрегация протопластов с бактериями, свободные бактерии удаляются повторным отмыванием. Далее растительные клетки культивируются на среде с добавлением гормонов, а через 3—4 недели небольшие колонии высеваются на безгормональную среду. На этой среде выживают только колонии трансформированных клеток.
Так были получены трансформированные растения-регенеранты табака и петунии. Этот метод дает возможность существенно расширить круг хозяев агробактерий, включая виды семейства злаковых. Эффективность кокультивирования может быть повышена применением индукторов слияния клеток (ПЭГ, кальций и др.).
Трансформация протопластов может быть проведена также кокультивированием их непосредственно с Ti-плазмидами, такие опыты были проведены с протопластами петунии, табака. Очень низкая эффективность включения Т-ДНК в протопласты, наблюдавшаяся в первых экспериментах, была затем увеличена благодаря химической стимуляции (ПЭГ). Из трансформированных клеток были получены трансгенные растения. Преимуществом этого метода является то, что отпадает необходимость в промежуточных векторах.
