Оценка токсичности загрязненных вод
| Виды загрязнения | Величина А, % | Оценка токсичности |
| Контроль Разлитие нефти Разбавление 1 Разбавление 2 Кислотный дождь Разбавление 1 Разбавление 2 Поверхностный сток с пестицидами Разбавление 1 Разбавление 2 Тяжелые металлы Разбавление 1 Разбавление 2 |
Графическим способом определяют для каждого варианта кратность разбавления стока, обеспечивающую его полную (ЛКр0) и 50 %-ную (ЛКр50) безопасность.
Вопросы для самоподготовки
1. Виды природных вод и особенности их состава.
2. Пути образования метана и сероводорода в анаэробных условиях.
3. Причины и пути эвтрофикации водоемов.
4. Процессы и стадии закисления водоемов.
5. Основные реакции фотосинтеза в природных водоемах.
6. Соединение металлов в воде. Пути накопления и превращения.
7. Механическая очистка сточных вод.
8. Химические методы очистки сточных вод.
9. Физико-химические методы очистки сточных вод.
10. Биологическая очистка сточных вод.
11. Биологические индикаторы загрязнения воды.
12. Сущность графического способа определения степени токсичности вод, содержащих загрязнители.
Лабораторная работа № 9
Определение содержания гумусовых веществ в почве
Гумусовые вещества представляют собой смесь различных по составу и свойствам высокомолекулярных азотсодержащих органических соединений, объединенных общностью происхождения и рядом свойств.
Гумусовые вещества по растворимости и экстрагируемости делят на большие группы: фульфокислоты, гумусовые кислоты, гумин, иногда выделяют группу гиматомелановых кислот.
В структуре гумусовых веществ условно выделяют ядерную и периферическую части. Ядерные фрагменты представлены преимущественно циклическими соединениями. Периферические части молекул представляют собой фрагменты, легко расщепляемые при гидролизе (имеют пептидные, сложноэфирные связи и др.). Периферические части относительно обогащены функциональными группами. Это прежде всего карбоксильные, аминогруппы, спиртовые и фенольные группы, карбонильные и др. Наличие этих функциональных групп определяет многие физико-химические свойства почв в целом: поглотительную способность почв, ее катионообменные свойства, способность связывать и аккумулировать в себе тяжелые металлы, регулировать содержание в почвенном растворе многих компонентов и др. Именно гумусовые соединения способны поддерживать определенное значение рН почвы, проявляя при этом буферные свойства.
Следует отметить, что в почвах до определенных пределов сохраняется постоянство состава гумусовых веществ. Изменение содержания какого-либо соединения с течением времени компенсируется тем, что данное соединение создается в таком же количестве за счет других гумусовых веществ или за счет поступающих в почву органических соединений.
Общее количество гумуса в почве определяют косвенно по количеству углерода в почве путем окисления гумусовых компонентов двухромовокислым калием.
Цель работы: познакомиться с органическими составляющими почвы, свойствами гумусовых соединений, научиться определять содержание гумусовых веществ в почве.
Оборудование и реактивы: образцы почвы, конические колбы на 100 мл, электроплитка, технические и аналитические весы, химические стаканы на 500 и 1000 мл, колба мерная на 1 л, 0,4 н. раствор хромовой смеси (40 г K2Cr2O7 растворяют в 600 … 800 мл дистиллированной воды в колбе на 1000 мл; после растворения объем раствора доводят до метки водой; затем раствор выливают в колбу из термостойкого стекла на 2…3 л и осторожно, при помешивании, вливают туда 1 л концентрированной H2SO4), 0,2 н. раствор соли Мора [(NH4)2SO4.FeSO4.6H2O], раствор дефиниламина C12H11N (5 г дефиниламина помещают в химический стакан и приливают, при помешивании, 100 мл H2SO4; затем осторожно приливают 20 г воды), концентрированная серная кислота (H2SO4, плотность 1,84), 85 %-ный раствор фосфорной кислоты (Н3РО4, плотность 1,7).
Порядок выполнения работы
8…10 г почвы, отделенной от растительных остатков и просеянной через сито 0,25 мм, поместить в коническую колбу на 100 мл. Из бюретки прилить точно 10 мл хромовой смеси (K2Cr2O7 в кислоте). Осторожно круговыми движениями взболтать содержимое.
Накрыв колбу воронкой, кипятить содержимое колбы ровно 5 мин. Отсчет времени начинают с момента появления пузырьков газа. Кипение должно быть медленным.
При нагревании идет реакция
2K2Cr2O7+8Н2SO4+3C(гумус) à 2K2SO4+2Cr2(SO4)3+8H2O+3CO2
По окончании кипения колбу снять с плитки, охладить до комнатной температуры. Перенести содержимое в колбу на 500 мл, смыть дистиллятом остатки с воронки и маленькой колбы и тоже перенести вместе с дистиллятом в колбу. Довести содержимое большой колбы до 250 мл. Добавить 2 мл 85 %-ного раствора фосфорной кислоты и восемь капель дифениламина в качестве индикатора (вместо дифениламина можно использовать 5 … 8 капель 2 %-ного раствора фенилантраниловой кислоты).
Содержимое колбы оттитровать 0,2 н. раствором соли Мора до перехода темно-бурой окраски через фиолетовую и синюю в грязно-зеленую. При появлении синего цвета титровать нужно осторожно.
Параллельно необходимо провести холостое титрование. Для этого взять 0,2 г прокаленного песка, поместить в коническую колбу на 100 мл, прилить 10 мл 0,4 н. раствора хромовой смеси, закрыть воронкой, прокипятить 5 мин, охладить и, добавив фосфорную кислоту и индикатор (как указано выше), оттитровать.
Вычислить процентое содержание гумуса в почвенном образце по формуле
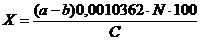 ,
,
где a – объем раствора соли Мора, затраченный на холостое титрование 10 мл хромовой смеси, мл; b – объем раствора соли Мора, затраченный на титрование содержимого колбы после окисления гумуса бихроматом калия, мл; N – концентрация соли Мора; 100 – коэффициент пересчета на 100 гпочвы; 0,0010362 – коэффициент пересчета на гумус (показывает, что 1 мл 0,2 н. раствора соли Мора соответствует такому количеству хромовой кислоты, которое окисляет 0,0010362 г гумуса, или 0,0006 г углерода).
Требования к отчету
В отчёте следует представить описание хода выполнения работы, результаты титрования, расчеты содержания гумусовых веществ в почве.
Лабораторная работа № 10
