Регуляция пищевого поведения
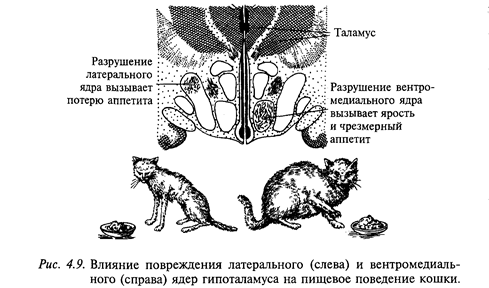
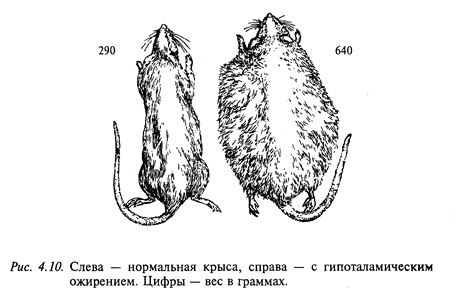
Регуляция пищевого поведения осуществляется рядом структур ЦНС и прежде всего двух взаимодействующих центров-центром голода (латеральное ядро гипоталамуса) и центром насыщения (вентромедиальное ядро гипоталамуса). Электрическая стимуляция центра голода провоцирует акт еды у сытого животного, тогда как стимуляция центра насыщения прерывает прием пищи. Разрушение центра голода вызывает отказ от потребления пищи (афагия) и воды, что часто приводит к гибели животного (рис. 4.9). Электрическая стимуляция латерального ядра гипоталамуса увеличивает секрецию слюнных и желудочных желез, желчи, инсулина, усиливает моторную деятельность желудка и кишечника. Повреждение центра насыщения увеличивает прием пищи (гиперфагия). Практически сразу после такой операции животное начинает есть много и часто, что приводит к гипоталамическому ожирению. На рис. 4.10 показаны две крысы: одна с нормальной массой тела, а другая - с гипоталамическим ожирением. При ограничении пищи масса тела уменьшается, но как только ограничения снимают, вновь проявляется гиперфагия, снижающаяся лишь при развитии ожирения. Эти животные проявляли также повышенную разборчивость при выборе пищи, предпочитая наиболее вкусную. Ожирение, следующее за повреждением вентромедиального ядра гипоталамуса, сопровождается анаболическими изменениями: изменяется обмен глюкозы, повышается уровень холестерина и триглицеридов в крови, снижается уровень потребления кислорода и утилизации аминокислот. Электрическая стимуляция вентромедиального гипоталамуса уменьшает секрецию слюнных и желудочных желез, инсулина, моторику желудка и кишечника. Таким образом, можно заключить, что латеральный гипоталамус вовлечен в регуляцию метаболизма и внутренней секреции, а вентромедиальный гипоталамус оказывает на нее тормозное влияние.
В норме сахар крови является одним из важных (но не единственным) факторов пищевого поведения. Его концентрация весьма точно отражает энергетическую потребность организма, а величина разности его содержания в артериальной и венозной крови тесно связана с ощущением голода или сытости. В латеральном ядре гипоталамуса имеются глюкорецепторы (нейроны, в мембране которых есть рецепторы к глюкозе), которые тормозятся при увеличении уровня глюкозы крови. Установлено, что их активность в значительной степени определяется глюкорецепторами вентромедиального ядра, которые первично активируются глюкозой. Гипоталамические глюкорецепторы получают информацию о содержании глюкозы в других частях тела. Об этом сигнализируют периферические глюкорецепторы, находящиеся в печени, каротидном синусе, стенке желудочно-кишечного тракта. Таким образом, глюкорецепторы гипоталамуса, интегрируя информацию, получаемую по нервным и гуморальным путям, участвуют в контроле приема пищи.
Получены многочисленные данные об участии различных мозговых структур в контроле приема пищи. Афагия (отказ от пищи) и адипсия (отказ от воды) наблюдаются после повреждения бледного шара, красного ядра, покрышки среднего мозга, черной субстанции, височной доли, миндалины. Гиперфагия (обжорство) развивается после повреждения лобных долей, таламуса, центрального серого вещества среднего мозга.
Несмотря на врожденный характер пищевых реакций, многочисленные данные показывают, что в регуляции приема пищи важная роль принадлежит условнорефлекторным механизмам. Это является основной причиной переедания и, следовательно, приобретения лишней массы тела современным человеком. Вспомните, каким обжорством мы страдаем, приходя в гости. В регуляции пищевого поведения участвуют многие факторы. Общеизвестно влияние на аппетит вида, запаха и вкуса пищи. Степень наполнения желудка также влияет на аппетит. Хорошо известна зависимость приема пищи от температуры окружающей среды: низкая температура стимулирует прием пищи, высокая - тормозит. Конечный приспособительный эффект всех механизмов, участвующих в пищевом поведении, состоит в приеме количества пищи, сбалансированного по калорийности с расходуемой энергией. Этим достигается постоянство массы тела.
