Энергии и длины связей в органических молекулах
| Связь | Энергия, кДж/моль | Длина, пм |
| С-С | 330-360 | 151-154 |
| С=С | 590-640 | |
| СºС | 810-840 | |
| С-Н | 402-455 | 107-110 |
| С-О | 350-381 | 136-143 |
| С=О | 680-760 | 115-122 |
| С-N | 270-314 | 133-148 |
| C=N | 598-616 | |
| CºN | 650-896 | |
| C-S | 260-276 | 175-181 |
Длина неполярной или малополярной связи примерно равна сумме ковалентных радиусов атомов.
lA-B = rA + rB (3)
Значения ковалентных радиусов для каждого элемента сильно зависят от его состояния в молекуле и ближайшего окружения, например, для углерода ковалентный радиус зависит от состояния гибридизации
| Элемент | C(sp3) | C(sp2) | C(sp) | N | O | H |
| r, пм | 33-37 |
ØВалентный угол – угол между условными линиями, соединяющими ядра химически связанных атомов (линиями связи).
Например, молекула воды имеет угловую форму с валентным углом НОН 104,5° и длиной связей О-Н 96 пм.
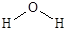
Энергия, необходимая для полной диссоциации молекулы, т.е. для осуществления процесса H2O ® 2H + O, составляет 924 кДж/моль. Поэтому энергия связи ОН равна 462 кДж/моль.
· Полярность ковалентной связи. В том случае, когда ковалентная связь образуется атомами с одинаковой электроотрицательностью, общая электронная пара в равной мере принадлежит партнерам. Такая связь называется ковалентной неполярной. Если же атомы, образующие связь, отличаются по электроотрицательности, общая электронная пара смещена к атому с большей электроотрицательностью. Образующаяся связь называется ковалентной полярной.
Вследствие несимметричного распределения электронной плотности двухатомные молекулы с ковалентной полярной связью представляют собой диполи - электронейтральные частицы, центры тяжести положительного и отрицательного заряда в которых не совпадают. При написании формул полярность ковалентной связи передают несколькими способами.
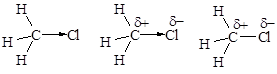
§ Количественной характеристикой полярности связи является ее дипольный момент, точнее электрический момент диполя.
m = d×qe×l (4),
где: qe - заряд электрона, l - длина связи.
Единицей измерения дипольного момента является Кл×м (SI) или внесистемная единица - Дебай (D = 3,34×10-30 Кл×м). Дипольный момент молекулы определяется как векторная сумма дипольных моментов ее связей и неподеленных электронных пар. Вследствие этого молекулярные частицы, имеющие одинаковую форму, но разные связи, могут сильно отличаться полярностью, например:
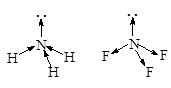
m = 1,47D m = 0,2D
§ Количественной мерой способности атома к оттягиванию электронов при образовании химических связей, является электроотрицательность (c). Электроотрицательность – величина условная и не поддается строгому экспериментальному определению. В настоящее время существует около 20 шкал электроотрицательности. Чаще всего используется относительная шкала электроотрицательности элементов, предложенная Л. Полингом[7].
Для типических элементов в периодах наблюдается монотонное увеличение электроотрицательности, например: Li 1,0; Be 1,5; B 2,0; C 2,5; N 3,0; O 3,5; F 4,0. В то же время в пределах группы с увеличением порядкового номера наблюдается немонотонность изменения электроотрицательности (вторичная периодичность), например: Li 1,0; Na 0,9; K 0,8; Rb 0,8; Cs 0,7. Причиной проявления вторичной периодичности является немонотонность увеличения радиуса атома с увеличением числа электронных оболочек.
Электротрицательность элемента, а, следовательно, и полярность его связей зависит от его валентного состояния и типа гибридизации, например:
| Элемент | C(sp3) | C(sp2) | C(sp) | N(sp3) | N(sp2) |
| c | 2,5 | 2,75 | 3,2 | 3,51 | 3,74 |
· Поляризуемость. Важной характеристикой ковалентной связи, в значительной мере определяющей ее реакционную способность, является поляризуемость – способность связи изменять полярность (перераспределять электронную плотность) под действием внешнего электростатического поля, источником которого могут служить катализатор, реагент, растворитель и т.д. Наведенный диполь частицы связан с напряженностью внешнего поля простым соотношением - m = aЕ. Коэффициент пропорциональности a является количественной характеристикой поляризуемости.
v Насыщаемостью и направленность ковалентной связи.Ковалентная связь обладает двумя важнейшими свойствами: насыщаемостью и направленностью. Насыщаемость ковалентной связи заключается в том, что атомы способны к образовании конечного числа ковалентных связей. Причиной насыщаемости ковалентной связи является ограниченное число валентных орбиталей атома, необходимых для образования связей как по обменному, так и по донорно-акцепторному механизму.
Количественно насыщаемость ковалентной связи характеризуется ковалентностью. Ковалентность (структурная валентность) равна числу ковалентных связей, образованных атомом.
Зная число орбиталей на валентных электронных уровнях, можно рассчитать максимальную теоретически возможную валентность для элементов разных периодов. У атомов элементов первого периода на валентном (первом) уровне находится только одна орбиталь (1s), поэтому водород во всех своих соединениях, в том числе и органических, одновалентен. Гелий, атом которого имеет полностью завершенный первый уровень, химических соединений не образует. У элементов второго периода валентным является второй энергетический уровень, содержащий четыре орбитали - 2s, 2px, 2py, 2pz. По этой причине максимальная ковалентность элементов второго периода, например, азота равна четырем.

nN = 3; nN = 4.
Следует отметить, что, если не считать водород, углерод является единственным элементом, для которого число валентных электронов совпадает с числом валентных орбиталей. Это позволяет ему образовывать прочные углеродные скелеты линейного или циклического, также и разветвленного строения, составляющие основу органических молекул.
Направленность ковалентной связи обусловлена стремлением атомов образовывать связи в направлении наибольшего перекрывания орбиталей, что обеспечивает максимальный выигрыш энергии. Это приводит к тому, что молекулы, образованные с участием ковалентных связей, имеют строго определенную форму.
v Гибридизация. Поскольку форму большинства молекул нельзя объяснить образованием ковалентных связей с участием стандартного набора атомных орбиталей, Л. Полинг разработал теорию гибридизации атомных орбиталей. Согласно этой теории процесс образования молекулярной частицы сопровождается выравниваем ковалентных связей за счет процесса гибридизации атомных орбиталей, который можно представить как смешивание волновых функций атомных орбиталей с образованием нового набора эквивалентных орбиталей. Сам по себе процесс гибридизации требует затраты энергии, но образование связей с участием гибридных орбиталей энергетически выгодно, поскольку обеспечивает более полное перекрывание электронных облаков и минимальное отталкивание электронных пар.
§ Наиболее простой является sp-гибридизация, которая реализуется при смешивании волновых функций s- и одной р-орбитали.
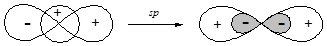
Образующиеся sp-гибридные орбитали ориентированы по одной оси в разные стороны, поэтому угол между связями, образованными с участием данных орбиталей составляет 180°. sp-Гибридизация атомов углерода реализуется в молекулах органических соединений при образовании тройных связей (алкины и нитрилы).
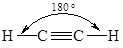
§ Участие в гибридизации s- и двух p-орбиталей приводит к образованию трех гибридных орбиталей (sp2-гибридизация), ориентированных от центра к вершинам правильного треугольника.
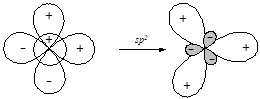
| Валентный угол между связями, образованными с участием гибридных орбиталей данного типа составляет 120°.sp2-Гибридизация атомов углерода реализуется в молекулах органических соединений при образовании двойных связей (алкены, альдемины и т.п.), а также ароматических систем, например, молекулы бензола. | 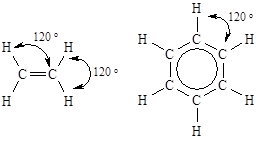 |
§ sp3-Гибридизация приводит к образованию набора из четырех энергетически равноценных орбиталей, ориентированных друг по отношению к другу под углом 109,5° от центра к вершинам тетраэдра.
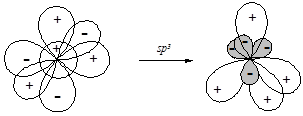
sp3-Гибридизация атомов углерода реализуется в молекулах предельных углеводоров (алканов) и их функциональных производных.
Рассмотрим в качестве примера строение некоторых молекул, образованных с участием sp3-гибридизованных орбиталей.
· Молекула метана – CH4. Из энергетической диаграммы атома углерода следует, что имеющихся двух неспаренных электронов недостаточно для образования четырех ковалентных связей по обменному механизму, поэтому образование молекулы метана происходит с участием атома углерода в возбужденном состоянии.
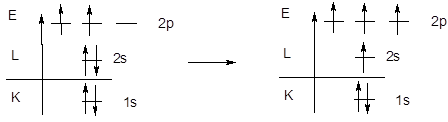
Равноценность связей и тетраэдрическая геометрия молекулы метана указывает на образование связей с участием sp3-гибридизованных орбиталей центрального атома.
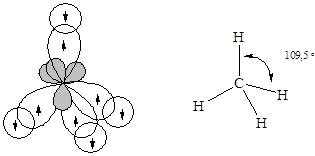
· Молекулааммиака – NH3. Атомные орбитали азота в молекуле аммиака также находятся в sp3-гибридизованном состоянии. Но поскольку только три орбитали задействованы в образовании связей азот-водород, а четвертая орбиталь содержит неподеленную электронную пару, молекула имеет пирамидальную форму. Отталкивающее действие неподеленной пары электронов приводит к уменьшению валентного угла от ожидаемого 109,5 до 107,3°.
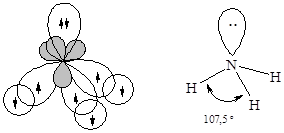
Наличие у атома азота неподеленной электронной пары позволяет ему образовать еще одну ковалентную связь по донорно-акцепторному механизму. Таким образом происходит образование молекулярного катиона аммония - NH4+. Образование четвертой ковалентной связи приводит к выравниванию валентных углов (109,5°) за счет равномерного отталкивания атомов водорода:
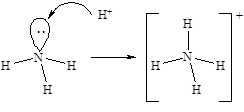
· Молекулаводы – H2O. Образование молекулы воды происходит с участием sp3-гибридных орбиталей атома кислорода, две из которых заняты неподеленными электронными парами и поэтому вклада в геометрию молекулы не вносят. Перекрывание одноэлектронных облаков двух гибридных орбиталей кислорода и 1s-орбиталей двух атомов водорода приводит к образованию уголковой молекулы. Отталкивающие действие двух неподеленных пар электронов уменьшает валентный угол HOH до 104,5°.
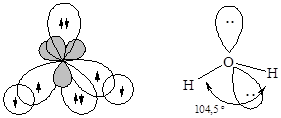
sp3-Гибридизация атома кислорода реализуется также в молекулах спиртов и простых эфиров.
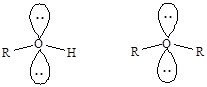
Рассмотренные примеры иллюстрируют преимущества метода ВС, в первую очередь, его наглядность и простоту описания строения молекул на качественном уровне. Присущи методу ВС и недостатки, в частности, он не позволяет объяснить образование делокализованных многоцентровых связей.
v Резонансные структуры. Для описания молекул с делокализованными связями метод ВС вынужден прибегать к специальному приему – резонансу валентных схем. Согласно концепции резонанса строение молекул с делокализованными связями передается не одной формулой, а наложением нескольких реально не существующих валентных схем (формул). Например, строение молекулы нитрометана, содержащей делокализованную трехцентровую связь, в методе ВС передается резонансом двух валентных схем.
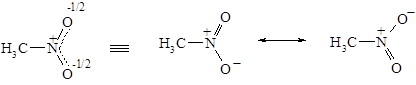
Находящиеся в резонансе валентные схемы содержат наряду с двойной связью азот-кислород т.н. семиполярную связь, которую можно рассматривать как комбинацию ковалентной и ионной связи.
Для описания молекулы бензола метод валентных связей вынужден прибегнуть к резонансу пяти канонических форм, наиболее важными из которых являются следующие:
 .
.
v Ионнаясвязь. Понятие об ионной связи используется в органической химии только при описании солеподобных соединений, например:

ацетат натрия хлорид тетраметиламмония
По этой причине мы не будем более подробно рассматривать особенности ионной связи, описание которой можно найти в соответствующих разделах учебников по общей и неорганической химии.
