Водородная связь, межмолекулярное взаимодействие
v Водородная связь
Ø Водородной связью называется электростатическое взаимодействие атома водорода, связанного с сильно электроотрицательным элементом, с другими атомами.
Водородные связи образует атом водорода, связанный с атомом фтора, кислорода или азота. Электроотрицательность других элементов недостаточна для того, чтобы заставить образовать прочную водородную связь связанный с ними атом водорода. Механизм образования водородной связи рассмотрим на примере взаимодействия молекул фтороводорода. Высокая электроотрицательность атома фтора приводит к тому, что связь водород-фтор в данной молекуле сильно полярна и общая пара электронов смещена к фтору H®F. Поскольку у атома водорода отсутствует внутренняя электронная оболочка, оттягивание его валентного электрона почти полностью обнажает ядро, представляющего собой элементарную частицу - протон. По этой причине сильно поляризованный атом водорода обладает очень мощным электростатическим полем, за счет которого он притягивается к атому фтора другой молекулы фтороводорода с образованием водородной связи:

Водородной связи присущи следующие особенности:
1. Водородная связь является насыщаемой. Атом водорода образует лишь одну водородную связь; его партнеры могут участвовать в образовании нескольких водородных связей.
2. Водородная связь является направленной. Фрагмент Х-Н××××Y обычно линейный, хотя в некоторых случаях может быть и угловым, но при этом величина валентного угла не сильно отличается от 180°.
3. Энергия водородной связи невелика (8-40 кДж/моль) и представляет величину того же порядка, что и энергия межмолекулярного взаимодействия. Прочность водородной связи тем выше, чем больше электроотрицательность партнера атома водорода. Так энергия связи H××××F составляет 25-40 кДж/моль, связи Н××××О - 19-21 кДж/моль, связей N××××H и S×××H - около 8 кДж/моль.
4. Водородная связь асимметрична: во фрагментах Х-Н××××Х длина связи Н××××Х больше длины Н-Х.
Водородная связь более длинная по сравнению с ковалентной и имеет меньшую энергию. Тем не менее, она оказывает очень большое влияние на физические свойства веществ, значительно увеличивая их температуры плавления и кипения. Так, фтороводород имеет т. пл. -83 °С и т. кип. +20 °С, в то время как его ближайший аналог - хлороводород плавится при - 114 °С и кипит при - 85 °С. Фактически, за счет водородных связей, фторофодород представляет собой полимер, который начинает частично диссоциировать только при температуре, близкой к температуре кипения. Но даже в газовой фазе фтороводород существует в виде малых ассоциатов молекул, в основном в виде димеров. В виде мономерных молекул фтороводород существует только при температурах выше 90 °С. Очень прочные водородные связи образует молекула воды, окруженная в кристаллическом состоянии (лед) четырьмя соседями.
Трехмерная сетка водородных связей, построенная из тетраэдров, существует и в жидкой воде во всем интервале температур от плавления льда и до ее кипения.
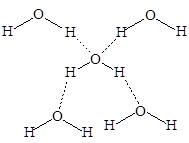
Наряду с межмолекулярными существуют и внутримолекулярные водородные связи, не оказывающие столь значительного влияния на физические свойства вещества.
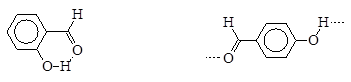
| 2-гидроксибензальдегид, т. пл. -7 ºС | 4-гидроксибензальдегид, т. пл. +117 ºС |
Муравьиная кислота НСООН и многие другие карбоновые кислоты в жидком и газообразном состояниях за счет водородных связей образует циклические димеры.
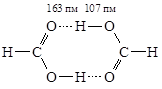
Очень важную роль водородные связи играют в организации многих биологически важных макромолекул (a-спирали и b-структуры белков и полипептидов, двойная спираль ДНК и т.д.).
v Силы межмолекулярного взаимодействия.
Ø Силами межмолекулярного взаимодействия (ван-дер-ваальсовыми силами) называют силы электростатического притяжения диполей вещества.
Данный вид взаимодействия атомных и молекулярных частиц отличается рядом особенностей:
1. Межмолекулярное взаимодействие является относительно слабым. Отвечающие ему эффекты на один-два порядка меньше тепловых эффектов образования ковалентных связей. Так, энергия связи для молекулы Н2 равна 432 кДж/моль, в то время как энтальпия сублимации кристаллического водорода, связанная с межмолекулярным взаимодействием, составляет 2,1 кДж/моль.
2. Межмолекулярное взаимодействие не является специфическим. Ван-дер-ваальсовые силы действуют между самыми разнообразными молекулами, одинаковыми или различными.
3. Силы Ван-дер-Ваальса имеют электростатическую природу, в связи с чем межмолекулярное взаимодействие является ненасыщаемым и ненаправленным.
По происхождению взаимодействующих диполей выделяют три типа сил межмолекулярного взаимодействия:
· Ориентационноевзаимодействие – электростатическое притяжение постоянных диполей вещества, которые ориентируются друг по отношению к другу противоположными полюсами.

Энергия ориентационного взаимодействия двух одинаковых молекул (ориентационный эффект) выражается следующим уравнением:
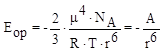 (9),
(9),
где m – дипольный момент молекулы, r – расстояние между молекулами.
· Индукционноевзаимодействие – электростатическое притяжение постоянного и наведенного (индуцированного) диполя.
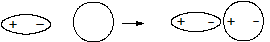
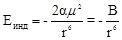 (10),
(10),
где a - поляризуемость молекулы.
· Дисперсионноевзаимодействие – электростатическое притяжение мгновенных микродиполей вещества. Возникновение мгновенных микродиполей вызвано случайным нарушением симметрии распределения электронной плотности в частице, приводящим к возникновению и исчезновению электрических полюсов. При проявлении сил дисперсионного взаимодействия мгновенные микродиполи появляются и исчезают синхронно, ориентируясь таким образом, чтобы частицы притягивались.

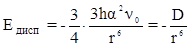 (11),
(11),
где h - постоянная Планка, n0 - частота колебаний молекул при температуре абсолютного нуля.
Естественно, что вклад дисперсионного взаимодействия в энергию межмолекулярного взаимодействия увеличивается при возрастании поляризуемости молекулы. Например, для HI энергия дисперсионного взаимодействия (60,47 кДж/моль) составляет 98,5% энергии сил межмолекулярного взаимодействия.
Действие сил Ван-дер-Ваальса приводит к сближению атомных и молекулярных частиц, не связанных химической связью, до некого равновесного состояния, в котором силы притяжения уравновешиваются силами отталкивания. При этом расстояние между атомами можно представить как сумму так называемых ван-дер-ваальсовских радиусов (табл. 3.3).
Таблица 3.3
