Основные теоретические положения
ОПРЕДЕЛЕНИЕ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
ЦЕЛЬ И МЕТОД РАБОТЫ
Определить численное значение универсальной газовой постоянной методом термостатирования.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
На базе экспериментальных законов Бойля-Мариотта, Гей-Люссака, Шарля, Клапейрон установил, что для разреженных газов выполняется соотношение
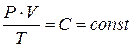 , (1)
, (1)
где P – давление газа (Па), V – объем газа (м3), T – абсолютная температура (К), C – газовая постоянная, зависящая от массы газа.
Соотношение (1) называют уравнением Клапейрона. Известно, что при нормальных условиях, т.е. при P=1 атм.=1,013×105 Па и T=273 К один моль любого газа занимает один и тот же объем, равный
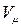 =22,4 литра=2,24×10-2 м3, поэтому для одного моля газа из соотношения (1) получаем:
=22,4 литра=2,24×10-2 м3, поэтому для одного моля газа из соотношения (1) получаем:
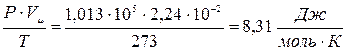 ,
,
или 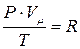 ,
,
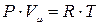 , (2)
, (2)
где величина R=8,31 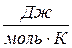 одинакова для всех газов и называется молярной газовой постоянной или универсальной газовой постоянной.
одинакова для всех газов и называется молярной газовой постоянной или универсальной газовой постоянной.
Для произвольной массы m газа его объем V можно записать в виде:
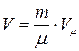 ,
,
откуда 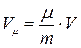 , (3) где
, (3) где 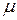 - масса одного моля газа (кг/моль);
- масса одного моля газа (кг/моль); 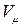 - объем одного моля газа
- объем одного моля газа 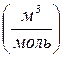
Подставляя соотношение (3) в (2) получим:
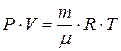 (4)
(4)
Уравнение (4) называется уравнением Клапейрона-Менделеева. Оно справедливо для реальных газов при давлениях, существенно не превосходящих атмосферное, и для так называемых идеальных газов. Идеальным газом называется газ, между молекулами которого отсутствуют силы взаимного притяжения и отталкивания, а сами молекулы имеют пренебрежимо малый объем. Идеальный газ определяется требованием подчинения законам Бойля-Мариотта, Гей-Люссака и Шарля.
Состояние газа или системы характеризуется параметрами состояния, т.е. значениями P, V и T. Если параметры состояния не изменяются бесконечно долгое время, то состояние называется равновесным. Переход газа (или системы) из одного равновесного состояния с параметрами P1 , V1 и T1 в другое равновесное состояние с параметрами P2, V2 и T2 называется процессом. Если процесс состоит из последовательности равновесных промежуточных состояний, то процесс называется равновесным.
Процесс, происходящий при постоянном давлении P=const,называется изобарическим.
Процесс, происходящий при постоянной температуре T=const, называется изотермическим.
Процесс, происходящий при постоянном объеме V=const, называется изохорическим.
Рассмотрим изобарический процесс расширения газа из состояния P1, V1 и T1 в состояние P2 , V2 и T2 (рис.1). Представим себе газ, заключенный в цилиндр с поршнем, движением которого изменяется объем газа. Будем считать, что движение поршня происходит без трения. Площадь поршня равна S. Сила F, создаваемая давлением P1 газа на поршень площади S, равна 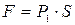 и, следовательно, работа, совершаемая газом при перемещении поршня на величину dh, равна
и, следовательно, работа, совершаемая газом при перемещении поршня на величину dh, равна 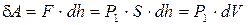 , где
, где 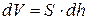 - изменение объема газа.
- изменение объема газа.
Условились считать, что работа, произведенная газом при увеличении его объема, имеет положительный знак, а работа произведенная внешними силами над газом, имеет отрицательный знак.
Работа изобарического расширения газа из состояния P1, V1, T1 в состояние P2 , V2 , T2 определяется интегралом
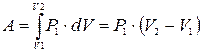 . (5)
. (5)
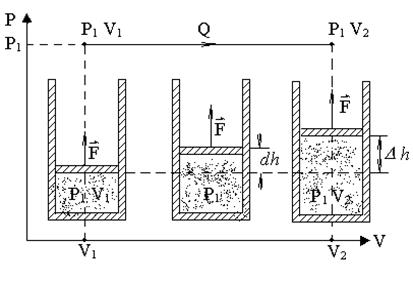 |
Так как при расширении газа объем увеличивается, то для сохранения постоянства давления к газу необходимо подводить теплоту Q.
Объем газа V1 в начальном состоянии согласно уравнения (4), равен
Рис. 1 Изобарический процесс расширения газа в координатах PV.
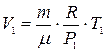 , (6)
, (6)
а объем газа V2 в конечном состоянии будет равен
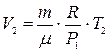 . (7)
. (7)
Из уравнений (6) и (7) получаем
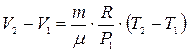 . (8)
. (8)
Подставив выражение (8) в уравнение (5) будем иметь:
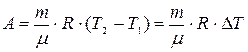 . (9)
. (9)
Если масса газа m равна массе одного моля газа m, а в процессе изобарического расширения температура газа увеличилась на 1К, т.е. 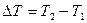 =1К, то из уравнения (9) мы получим
=1К, то из уравнения (9) мы получим
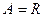 (10)
(10)
Таким образом, универсальная газовая постоянная R численно равна работе, совершаемой одним молем идеального газа при изобарическом расширении вследствие нагревания на один Кельвин.
ВЫВОД РАБОЧЕЙ ФОРМУЛЫ
В результат проведения лабораторной работы известны:
1. Объем воздуха в сосуде V.
2. Атмосферное давление P.
3. Плотность воздуха в сосуде r.
4. Изменение объема DV воздуха в сосуде в результате изменения температуры воздуха на величину DT при P=const.
Рассчитать универсальную газовую постоянную.
При расширении воздуха в условиях P=const, работа, совершаемая воздухом равна
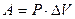 , (11)
, (11)
где 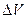 - изменение объема воздуха при расширении.
- изменение объема воздуха при расширении.
Приравнивая правые и левые части уравнений (9) и (11), получим
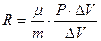 , (12)
, (12)
где  - изменение температуры воздуха в сосуде; m - масса воздуха в сосуде.
- изменение температуры воздуха в сосуде; m - масса воздуха в сосуде.
Изменение объема 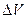 воздуха можно определить по изменению уровня жидкости в левом колене манометра (см. рис. 2), вызванное расширением воздуха при его нагреве:
воздуха можно определить по изменению уровня жидкости в левом колене манометра (см. рис. 2), вызванное расширением воздуха при его нагреве:
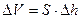 , (13)
, (13)
где S – площадь поперечного сечения трубки манометра;
 - изменение уровня жидкости в левом колене манометра, взятое по шкале в мм.
- изменение уровня жидкости в левом колене манометра, взятое по шкале в мм.
Массу m воздуха в сосуде можно определить по плотности r воздуха, взятой из таблиц в зависимости от температуры и давления при начальных условиях опыта, т.е.
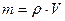 . (14)
. (14)
С учетом (13) и (14) из уравнения (12) получим
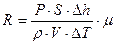 - рабочая формула.
- рабочая формула.
Величина 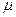 для воздуха равна 29 10-3
для воздуха равна 29 10-3 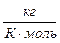 .
.
