Номенклатура оптических изомеров
В номенклатуре наряду с названием соединения указывают также конфигурацию и направление вращения плоскости поляризованного света. Последнее обозначают знаком (+) для правовращающего изомера или знаком (—) для левовращающего изомера.
Для обозначения конфигурации оптических изомеров существуют D,L- и R,S-стереохимические системы.
D,L-система обозначения конфигурации. Установить абсолютную конфигурацию молекул оказалось для химиков довольно сложной задачей. Впервые это удалось лишь в 1951 г методом рентгеноструктурного анализа. До этого времени конфигурацию оптических изомеров устанавливали методом сравнения со специально выбранным стандартным веществом. Такая конфигурация получила название относительной. В 1906 г. русским ученым М.А. Розановым в качестве стандарта для установления относительной конфигурации был предложен глицериновый альдегид.
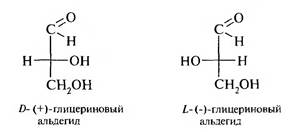
Для правовращающего изомера выбрали формулу Фишера, в которой гидроксильная группа у хирального атома углерода находится справа, а для левоврашаюшего — слева. Конфигурация правовращающего изомера обозначается буквой D, а левоврашаюшего — L.
С использованием в качестве эталона сравнения глицеринового альдегида была разработана D,L-система стереохимической классификации хиральных соединений, т. е. отнесения соединений соответственно к D- или к L- стереохимическому ряду.
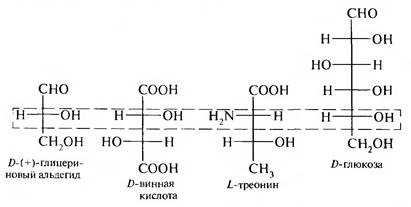
D,L-система главным образом применяется в ряду многоатомных спиртов, гилроксн-, аминокислот и углеводов:
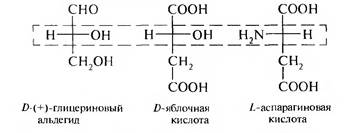
Для соединений с несколькими асимметрическими атомами углерода. таких как α-гидроксикислоты, α-аминокислоты, винные кислоты. конфигурацию условно определяют по верхнему асимметрическому атому углерода (по гидроксикислотному ключу), в то время как в молекуле углеводов конфигурацию устанавливают (условно) по нижнему асимметрическому атому углерода.
R,S-снстема обозначения конфигурации.D,L-система оказалась практически неприемлемой для соединений мало похожих на глицериновый альдегид. Поэтому Р. Каном, К. Ингольдом и В. Прелогом была предложена R,S -система обозначения абсолютной конфигурации оптических изомеров. R,S-система построена на определении старшинства заместителей у хирального центра.
Старшинство заместителей определяется величинами атомных номеров элементов. Чем больше атомный номер, тем старше заместитель. Например, в молекуле бромйодхлорметана старшинство заместителей уменьшается в ряду:
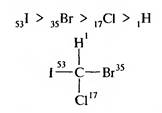
После установления старшинства заместителей модель молекулы ориентируют так, чтобы заместитель с наименьшим порядковым номером был направлен в сторону, противоположную глазу наблюдателя. Если старшинство трех остальных заместителей убывает по направлению часовой стрелки, то молекула имеет конфигурацию, обозначаемую буквой R (от лат. rectus — правый), а если старшинство заместителей убывает против часовой стрелки, конфигурацию обозначают буквой S (от лат. sinister—левый).
Рацематы. Смесь равных количеств энантиомеров оптически неактивна, ее называют рацемической смесью (рацематом). Рацематы отличаются от индивидуальных энантиомеров физическими свойствами, они могут иметь различную температуру плавления, растворимость; отличаются спектральными характеристиками.
На практике чаще приходится сталкиваться не с индивидуальными энантиомерами, а рацематами, которые образуются в результате химических реакций, протекающих с образованием хиральных молекул.
Для разделения рацематов на энантиомеры пользуются тремя методами:
1.Механический метод. В результате кристаллизации некоторых оптически активных соединений могут образовываться две формы кристаллов, похожих друг на друга как предмет и его зеркальное отображение. Их можно отделить под микроскопом препаративной иглой (механически).
2.Биохимический метод основан на том, что определенные виды микроорганизмов предпочитают одну из энантиомерных форм и поедают ее, вторая остается и может быть легко выделена.
3.Химический метод. В основе химического метода лежит перевод энантиомеров при помощи оптически активных реагентов в диастереомеры, которые уже отличаются друг от друга по физическим свойствам. Диастереомеры гораздо легче разделить.
