Коагуляция золей смесями электролитов (совместная коагуляция)
Коагуляция осложняется при применении смеси электролитов. При этом воз-можны 3 варианта действия электролитов. Аддитивность – суммарное коагули-рующее действие электролитов. Имеет место при отсутствии взаимодействия меж-ду ионами разных электролитов, т.е. когда электролиты содержат противоионы одинаковой валентности. Если один электролит присутствует в количестве 70% от его порога коагуляции, то для вызова коагуляции необходимо взять второй элек-тролит в количестве 30% от его порога коагуляции.
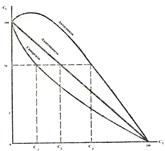 | Синергизм – явление взаимного усиления коагули-рующего действия электролитов. Обусловлено химическим взаимодействием ионов смеси с образованием ионов с большим зарядом, чем исходные ионы. В связи с этим, согласно правила Шульца-Гарди, новообразованные ионы обладают большей коагулирующей способностью. Поэтому, чтобы вызвать коагуляцию, второй электролит должен быть взят в количестве, меньше 30% от его порога коагуляции. |
Антогонизм ( пептизация) – явление взаимного ослабления коагулирующей способности электролитов. Обусловлено образованием новых ионов, обладающих меньшим зарядом по сравнению с зарядом исходных ионов. Поэтому, чтобы вызвать коагуляцию, их суммарная концентрация должна быть больше 100%.
Взаимная коагуляция золей
Взаимная коагуляция наблюдается при смешении золей с разноименно заряженными частицами. Разноименно заряженные частицы притягиваются друг к другу с образованием агрегатов вследствие исчезновения электростатического отталкивания, т.е взаимной нейтрализации зарядов. Наиболее полно она наблюдается тогда, когда заряды частиц приблизительно равны.
Взаимная коагуляция имеет место в жидкостях организма, используется при выделении каучука из латекса, при очистке промышленных вод, крашении тканей и волокон, в водоподготовке.
Например, природные воды содержат большое количество примесей коллоидных веществ (песок, глина и др.), имеющих отрицательный заряд:
{ m xAl2O3.ySiO2.zMe2O.nSiO44−(n−q)Men+}q−.qMen+
Для их нейтрализации вводят коагулянты (сульфаты алюминия, железа, аммонийные квасцы). В воде эти соли гидролизуются и образуют коллоидные частицы с положительным зарядом:
Fe2(SO4)3 + H2O → Fe(OH)3 + H2SO4
{mFe(OH)3. nFe3+3(n−x)HSO4−]x+.xHSO4−
Эти гранулы взаимно нейтрализуются с отрицательно заряженными частицами и выпадают в осадок, которого отфильтровывают и таким образом получают очищенную (осветленную) воду.
Кинетика коагуляции
Теория кинетики коагуляции разработана Смолуховским. Кинетика коагу-ляции выражается скоростью коагуляции, т.е. изменением численной концентра-ции частиц в единицу времени. В зависимости от концентрации коагулирующего электролита ход коагуляции подразделяют на скрытую и явную.
При небольшой концентрации электролита коагуляция незаметна на глаз и называется скрытой коагуляцией. При этом заряд коллоидных частиц большой и поэтому только некоторые частицы (имеющие максимальную скорость движения) могут преодолеть силы электростатического отталкивания. По мере увеличения концентрации электролита заряд частиц постепенно нейтрализуется, дзета-потен-циал уменьшается и достигает критического значения. В этой точке коагуляция становится заметной на глаз и такая коагуляция называется явной.
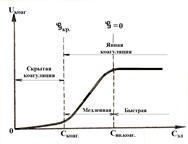 Рис. Кинетика коагуляции Рис. Кинетика коагуляции | Явная коагуляция подразделяется на медлен-ную и быструю. При концентрации электро-лита, чуть больше порога коагуляции, дзета-потенциал частиц становится меньше крити-ческого, но еще не равен нулю. Поэтому не каждое столкновение ведет к слипанию частиц и их оседанию. Вследствие этого явная коагу-ляция протекает медленно. По мере увеличе-ния концентрации электролита скорость коагуляции увеличивается, частицы нейтрали- |
зуются и заряд становится равным нулю. При этом ничто не мешает коагуляции: каждое столкновение ведет к объединению частиц. Практически все частицы коагулируют одновременно. Поэтому явная коагуляция протекает быстро. Скорость коагуляции уже не зависит от дальнейшего увеличения концентрации электролита. Минимальная концентрация электролита, которая вызывает быструю явную коагуляцию, называют критическим порогом быстрой коагуляции.
