Структура воды в трех ее агрегатных состояниях
Структура воды
Взаимное проникновение атомов водорода и кислорода. Ядра двух атомов водорода и две пары электронов находятся в углах тетраэдра: в центре расположено ядро атома кислорода.
Высокие величины поверхностного натяжения и теплоты парообразования воды объясняются тем, что для отделения молекулы воды от группы молекул требуется относительно большая затрата энергии. Стремление молекул воды устанавливать водородные связи и их полярность объясняют необычно высокую растворяющую способность воды. Некоторые соединения, такие, как сахара и спирты, удерживаются в растворе благодаря водородным связям. Соединения, обладающие высокой степенью ионизации вводе, например хлористый натрий, удерживаются в растворе вследствие того, что ионы с противоположными зарядами нейтрализуются группами ориентированных молекул воды.
Другая особенность молекулы воды состоит в том, что как атомы водорода, так и атомы кислорода могут иметь различные массы при одинаковом заряде ядра. Разновидности химического элемента с различными атомными весами называются изотопами этого элемента. Молекула воды обычно образуется водородом с атомным весом 1 (Н1) и кислородом с атомным весом 16 (О16). Более 99% атомов воды относится к этим изотопам. Кроме того, существуют следующие изотопы: Н2, H3, О14, О15, О17 О18, О19. Многие из них скапливаются в воде в результате ее частичного испарения и вследствие своей большой массы. Изотопы Н3, О14, О15, О19 радиоактивны. Наиболее распространен из них тритий Н3, образующийся в верхних слоях атмосферы под воздействием космических лучей. Этот изотоп накопился также в результате ядерных взрывов за последние несколько лет. На основании этих и других фактов относительно изотопов путем анализа изотопного состава воды можно частично раскрыть историю некоторых природных вод. Так, содержание тяжелых изотопов в поверхностных водах свидетельствует о длительном испарении воды, которое происходит, например, в Мертвом море, Большом Соленом озере и в других бессточных водоемах. Повышенное содержание трития в подземных водах могло бы означать, что эти воды метеорного происхождения с большой скоростью циркуляции, потому что период полураспада этого изотопа всего лишь 12,4 лет. К сожалению, изотопный анализ слишком дорог и по этой причине не может быть широко применен в исследованиях природных вод
Молекула воды H2О построена в виде треугольника: угол между двумя связками кислород – водород 104 градуса. Но поскольку оба водородных атома расположены по одну сторону от кислорода, электрические заряды в ней рассредоточиваются. Молекула воды полярная, что является причиной особого взаимодействия между разными её молекулами.
Атомы водорода в молекуле H2О, имея положительный частичный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называется водородной. Она объединяет молекулы H2О в своеобразные полимеры пространственного строения; плоскость, в которой расположены водородные связи, перпендикулярны плоскости атомов той же молекулы H2О. Взаимодействием между молекулами воды и объясняются в первую очередь незакономерно высокие температуры её плавления и кипения. Нужно подвести дополнительную энергию, чтобы расшатать, а затем разрушить водородные связи. И энергия эта очень значительна. Вот почему так велика теплоёмкость воды.
Как и большинство веществ, вода состоит из молекул, а последние из атомов.
Структура атома следующая: вокруг положительно заряженного протонного ядра на определенных уровнях по различным орбитам движутся отрицательно заряженные электроны, образующие электронное облако. Число электронов в каждой оболочке для атома каждого элемента строго определенное. Так, у атома водорода лишь одна оболочка с единственным электроном, а у атома кислорода две оболочки: внутренняя с двумя электронами и внешняя с шестью.
Два атома водорода замещают вакансию двух недостающих (до восьми) электронов наружной оболочки для ее устойчивости. Можно было бы предполагать, что атом кислорода и два атома водорода в молекуле воды образуют у центрального атома кислорода угол, близкий к 180°. Однако в действительности он значительно меньше - всего 104° 27' (рис.1.2), что приводит к неполной компенсации внутримолекулярных сил, избыток которых обусловливает асимметрию распределения зарядов, создающую полярность молекулы воды. Эта полярность у воды, более значительная, чем у других веществ, обусловливает ее дипольный момент и диэлектрическую проницаемость. Последняя у воды весьма велика и определяет интенсивность растворения водой различных веществ. При 0 °С диэлектрическая проницаемость воды (в твердой фазе) составляет 74,6; с повышением температуры она падает.
Так, при 20° С диэлектрическая проницаемость воды равна 81. Что это значит? Это значит, что два противоположных электрических заряда в воде взаимно притягиваются с силой, равной ~ 1/80 их взаимодействия в воздухе, и что отделение ионов от кристаллов какой-либо соли в воде в 80 раз легче, чем в воздухе.
Многочисленные схемы строения молекулы воды являются гипотетическими, построенными на косвенных наблюдениях приборами некоторых признаков поведения и свойств молекул и атомов. При этом следует помнить, что ни атомы, ни молекулы не имеют четких границ из-за неопределенности как формы, так и точных размеров орбит, по которым движутся электроны, образующие по сути дела электронное облако, зависящее от энергетического состояния электрона. Последнее может быть спокойным или возбужденным, что зависит, в частности, и от температуры. Отсюда разнобой в значениях вычисленных радиусов, а также схематичность гипотетических моделей атомов и молекул.
Структура воды в трех ее агрегатных состояниях
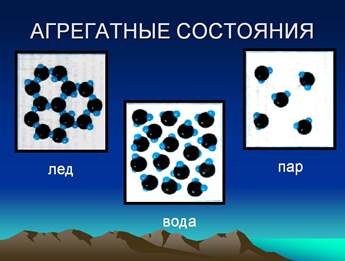
Проблема оценки структуры воды пока остается одной из самых сложных. Рассмотрим кратко две обобщенные гипотезы о структуре воды, получившие наибольшее признание, одна — в начальный период развития учения о структуре воды, другая — в настоящее время.
Согласно гипотезе, предложенной Уайтингом (1883г.) и имеющей к настоящему времени различные интерпретации, основной строительной единицей водяного пара является молекула H2O, называемая гидроль, или моногидроль. Основной строительной единицей воды является двойная молекула воды (H2O)2—дигидроль; лед же состоит из тройных молекул (H2O)3 — тригидроль. На этих представлениях основана так называемая гидрольная теория структуры воды.
Водяной пар, согласно этой теории, состоит из собрания простейших молекул моногидроля и их ассоциаций, а также из незначительного количества молекул дигидроля.
Вода в жидком виде представляет собой смесь молекул моногидроля, дигидроля и тригидроля. Соотношение числа этих молекул в воде различно и зависит от температуры. Согласно этой гипотезе, соотношение количества молекул воды и объясняет одну из основных ее
Так как молекула воды несимметрична, то центры тяжести положительных и отрицательных зарядов ее не совпадают. Молекулы имеют два полюса — положительный и отрицательный, создающие, как магнит, молекулярные силовые поля. Такие молекулы называют полярными, или диполями, а количественную характеристику полярности определяют электрическим моментом диполя, выражаемым произведением расстояния l между электрическими центрами тяжести положительных и отрицательных зарядов молекулы на заряд e в абсолютных электростатических единицах:
Для воды дипольный момент очень высокий: p = 6,13·10-29 Кл·м. Полярностью молекул моногидроля и объясняется образование дигидроля и тригидроля. Вместе с тем, так как собственные скорости молекул возрастают с повышением температуры, этим можно объяснить постепенный распад тригидроля в дигидроль и далее в моногидроль соответственно при таянии льда, нагревании и кипении воды.
Другая гипотеза строения воды, разрабатывавшаяся в XX веке (модели О.Я.Самойлова, Дж.Попла, Г.Н.Зацепиной и др.), основана на представлении, что лед, вода и водяной пар состоят из молекул H2O, объединенных в группы с помощью так называемых водородных связей (Дж.Бернал и Р.Фаулер, 1933г.). Эти связи возникают в результате взаимодействия атомов водорода одной молекулы с атомом кислорода соседней молекулы (с сильно электроотрицательным элементом). Такая особенность водородного обмена в молекуле воды обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом (см. рис.1.3), он остается в виде ядра, почти лишенного электронной оболочки. Поэтому атом водорода не испытывает отталкивания от электронной оболочки кислорода соседней молекулы воды, а, наоборот, притягивается ею, и может вступить с нею во взаимодействие. Согласно изложенному, можно предположить, что силы, образующие водородную связь, являются чисто электростатическими. Однако, согласно методу молекулярных орбиталей, водородная связь образуется за счет дисперсионных сил, ковалентной связи и электростатического взаимодействия.
Строение молекулы
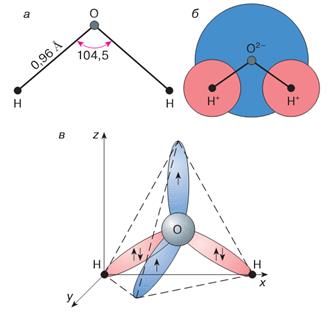 Как известно, свойства химических соединений зависят от того, из каких элементов состоят их молекулы, и изменяются закономерно. Воду можно рассматривать как оксид водорода или как гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О – Н 0,957 нм; валентный угол Н – О – Н 104o 27’.
Как известно, свойства химических соединений зависят от того, из каких элементов состоят их молекулы, и изменяются закономерно. Воду можно рассматривать как оксид водорода или как гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О – Н 0,957 нм; валентный угол Н – О – Н 104o 27’.
Но поскольку оба водородных атома расположены по одну сторону от кислородного, электрические заряды в ней рассредоточиваются. Молекула воды полярна, что является причиной особого взаимодействия между разными её молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называется водородной. Она объединяет молекулы воды в своеобразные полимеры пространственного строения.
