Первый постулат Бора: постулат стационарных состояний
Содержание
[убрать]
· 1 Полуклассическая теория Бора
· 2 Формула Зоммерфельда — Дирака
· 3 Достоинства теории Бора
· 4 Недостатки теории Бора
· 5 Примечания
· 6 Литература
Полуклассическая теория Бора[править | править вики-текст]
Основана на двух постулатах Бора:
· Атом может находиться только в особенных стационарных или квантовых состояниях, каждому из которых отвечает определённая энергия. В стационарном состоянии атом не излучает электромагнитных волн.
· Излучение и поглощение энергии атомом происходит при скачкообразном переходе из одного стационарного состояния в другое, при этом имеют место два соотношения:
1.  где
где  — излучённая (поглощённая) энергия,
— излучённая (поглощённая) энергия, 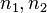 — номера квантовых состояний. В спектроскопии
— номера квантовых состояний. В спектроскопии 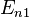 и
и 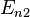 называются термами.
называются термами.
2. Правило квантования момента импульса: 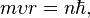
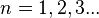
Далее исходя из соображений классической физики о круговом движении электрона вокруг неподвижного ядра по стационарной орбите под действием кулоновской силы притяжения, Бором были получены выражения для радиусов стационарных орбит и энергии электрона на этих орбитах:
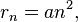
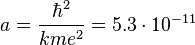 м — боровский радиус.
м — боровский радиус.
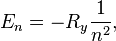
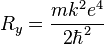 — энергетическая постоянная Ридберга (численно равна 13,6 эВ).
— энергетическая постоянная Ридберга (численно равна 13,6 эВ).
Формула Зоммерфельда — Дирака[править | править вики-текст]
Движение электрона вокруг атомного ядра в рамках классической механики можно рассматривать как «линейный осциллятор», который характеризуется «адиабатичным инвариантом», представляющим собой площадь эллипса (в обобщённых координатах):
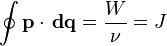
где — 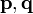 — обобщённый импульс и координаты электрона,
— обобщённый импульс и координаты электрона, 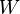 — энергия,
— энергия, 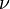 — частота. А квантовый постулат утверждает, что площадь замкнутой кривой в фазовой
— частота. А квантовый постулат утверждает, что площадь замкнутой кривой в фазовой 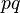 — плоскости за один период движения, равна целому числу умноженному на постоянную Планка
— плоскости за один период движения, равна целому числу умноженному на постоянную Планка 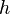 (Дебай, 1913 г.). С точки зрения рассмотрения постоянной тонкой структуры наиболее интересным является движение релятивистского электрона в поле ядра атома, когда его масса зависит от скорости движения. В этом случае мы имеем два квантовых условия:
(Дебай, 1913 г.). С точки зрения рассмотрения постоянной тонкой структуры наиболее интересным является движение релятивистского электрона в поле ядра атома, когда его масса зависит от скорости движения. В этом случае мы имеем два квантовых условия:
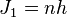 ,
, 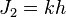 ,
,
где 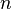 определяет главную полуось эллиптической орбиты электрона (
определяет главную полуось эллиптической орбиты электрона ( 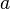 ), а
), а 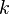 — его фокальный параметр
— его фокальный параметр 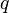 :
:
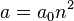 ,
, 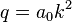 .
.
В этом случае Зоммерфельд получил выражение для энергии в виде
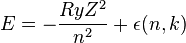 .
.
где 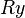 — постоянная Ридберга, а
— постоянная Ридберга, а 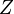 — порядковый номер атома (для водорода
— порядковый номер атома (для водорода 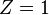 ).
).
Дополнительный член 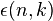 отражает более тонкие детали расщепления спектральных термов водородоподобных атомов, а их число определяется квантовым числом
отражает более тонкие детали расщепления спектральных термов водородоподобных атомов, а их число определяется квантовым числом 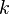 . Таким образом сами спектральные линии представляют собой системы более тонких линий, которые соответствуют переходам между уровнями высшего состояния (
. Таким образом сами спектральные линии представляют собой системы более тонких линий, которые соответствуют переходам между уровнями высшего состояния ( 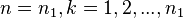 ) и низшего состояния (
) и низшего состояния ( 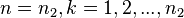 ). Это и есть т. н. тонкая структура спектральных линий. Зоммерфельд разработал теорию тонкой структуры для водородоподобных атомов (
). Это и есть т. н. тонкая структура спектральных линий. Зоммерфельд разработал теорию тонкой структуры для водородоподобных атомов ( 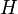 ,
, 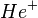 ,
, 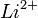 ), а Фаулер с Пашеном на примере спектра однократно ионизированного гелия
), а Фаулер с Пашеном на примере спектра однократно ионизированного гелия 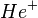 установили полное соответствие теории с экспериментом.
установили полное соответствие теории с экспериментом.
Зоммерфельд (1916 г.) еще задолго до возникновения квантовой механики Шредингера получил феноменологичную формулу для водородных термов в виде:
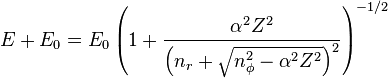 ,
,
где 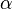 — постоянная тонкой структуры,
— постоянная тонкой структуры, 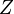 — порядковый номер атома,
— порядковый номер атома, 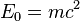 — энергия покоя,
— энергия покоя, 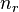 — радиальное квантовое число, а
— радиальное квантовое число, а 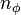 — азимутальное квантовое число. Позднее эту формулу получил Дирак, используя релятивистское уравнения Шрёдингера. Поэтому сейчас эта формула и носит имя Зоммерфельда — Дирака.
— азимутальное квантовое число. Позднее эту формулу получил Дирак, используя релятивистское уравнения Шрёдингера. Поэтому сейчас эта формула и носит имя Зоммерфельда — Дирака.
Появление тонкой структуры термов связана с прецессией электронов вокруг ядра атома. Поэтому появление тонкой структуры можно обнаружить по резонансному эффекту в области ультракоротких электромагнитных волн. В случае 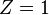 (атом водорода) величина расщепления близка к
(атом водорода) величина расщепления близка к
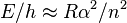
Поскольку длина электромагнитной волны равна
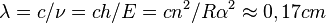
Поэтому для 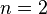 это будет почти 1 см.
это будет почти 1 см.
Достоинства теории Бора[править | править вики-текст]
· Объяснила дискретность энергетических состояний водородоподобных атомов.
· Теория Бора подошла к объяснению внутриатомных процессов с принципиально новых позиций, стала первой полуквантовой теорией атома.
· Эвристическое значение теории Бора состоит в смелом предположении о существовании стационарных состояний и скачкообразных переходов между ними. Эти положения позднее были распространены и на другие микросистемы.
· Объясняет границу таблицы Менделеева. Последний атом, способный существовать физически, имеет порядковый номер 137, так как, начиная со 138-го элемента 1s-электрон должен двигаться со сверхсветовой скоростью, что противоречит специальной теории относительности.
Недостатки теории Бора[править | править вики-текст]
· Не смогла объяснить интенсивность спектральных линий.
· Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева без экспериментальных данных (энергии ионизации или других).
· Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движенияэлектрона — классическое, другое — уравнение квантования орбит — квантовое.
Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования широко используются и в наши дни как приближённые соотношения: их точность часто бывает очень высокой.
Вопрос2
Первый постулат Бора: постулат стационарных состояний
