Способы образования ковалентной связи
ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА
характеризует разность между числом электронов, принадлежащих данному атому в хим. соед., и числом электронов своб. атома. Для оценок Э. з. а. используют модели, в к-рых экспериментально определяемые величины представляют как ф-ции точечных неполяризуемых зарядов, локализованных на атомах; напр., дипольный момент двухатомной молекулы рассматривают как произведение Э. з. а. на межатомное расстояние. В рамках подобных моделей Э. з. а. можно рассчитать, используя данные оптич. или рентгеновской спектроскопии, ЯМР и др. Однако, поскольку электронная плотность в хим. соед. делокализована и границ между атомами не существует, нельзя описать разл. характеристики соед. одним набором Э. з. а.; значения этого показателя, определенные разными эксперим. методами, могут не совпадать. Э. з. а. можно определить также на основе квантовохим. расчетов.
Э. з. а., определенные в рамках к.-л. одной модели или в однотипных расчетах, используют для корреляции с различными физ.-хим. характеристиками соед., установления реакц. центров в молекулах, оценки степени ионности хим. связи. Особенно важно, что для кислорода в большинстве неорг. соединений даже таких, как MgO и СаО, отрицательный З. э. получен близким к единице — от —0,9 до —1,1 (Урусов, 1966; Баринский, Нефедов, 1967 и др.). Связанные же с кислородом атомы Si, S, Cl, Cr, Mn могут иметь максимальные заряды соответственно 1,97; 2,49; 2,27; 2,0; 2,0, вместо предполагавшихся в соответствующих соединениях Si4+, S6+, Cl7+, Cr6+, Mn7+. В разл. соединениях З. э. колеблются. Так, по данным существующих исследований Si в оливине имеет З. э. равный 1,55, а в кварце 1,97, Al в анортите 1,23, а в А12О3 1,53, Mg в MgO 1,01, а в Mg(ClO4)2 1,46, Na в Na3PO4 0,83, а в Na3SO4 1,0, и т. д.
Способы образования ковалентной связи
Существуют два главных способа образования ковалентной связи *.
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденныхатомах
.Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень:
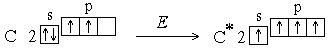
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей*, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободныеорбитали возможны только в пределах одного энергетического уровня.
Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s22s22p63s13p33d1 (валентность 5)
S* 1s22s22p63s13p33d2 (валентность 6)
Cl* 1s22s22p63s13p33d3 (валентность 7)
В приведенных выше электронных формулах* возбужденных атомов подчеркнуты подуровни*, содержащие только неспаренныеэлектроны. На примере атома хлора легко показать, что валентность может быть переменной:
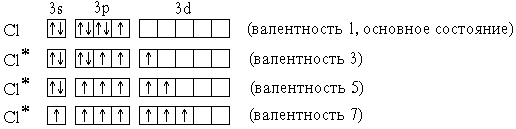
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуют орбитали d-подуровня и другие вакантные орбитали.
2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиакаи иона водорода можно отобразить схемой:
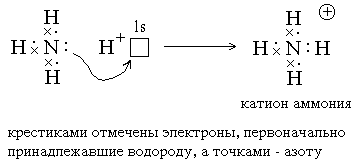
Атом, предоставляющий свою электронную пару для образования ковалентной связи*, называется донором, а атом, предоставляющий пустую орбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью. В катионе аммония эта связь по своим свойствам абсолютно идентична трем другим ковалентным связям, образованным первым способом, поэтому термин “донорно-акцепторная” обозначает не какой-то особый вид связи, а лишь способ ее образования.
Или,если краткооо
Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
| H• + •H ® H : H |  | ® |  |
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
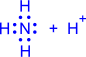 | ® | 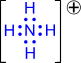 |
