Концентрации растворов
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
С ИСПОЛЬЗОВАНИЕМ
КОНЦЕНТРАЦИИ РАСТВОРОВ
Задача 1. Сколько граммов КОН надо растворить в 100 г воды, чтобы получить раствор с массовой долей 6 %?
Решение. По определению массовой доли (w) известно, что в 100 г раствора будет содержаться 6 г КОН.
mраствора = mрастворенного в-ва + m 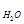 ;
;
следовательно, m 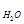 = 100 г раствора – 6 г = 94 г,
= 100 г раствора – 6 г = 94 г,
тогда в 94 г Н2О содержится 6 г КОН, а
в 100 г Н2О » х г КОН; х = 6,38 г КОН.
Задача 2. Какой объем 96 %-ной (по массе) серной кислоты (плотность раствора, r = 1,84 г/см3) и какую массу воды надо взять для приготовления 100 мл 15%-ного (по массе) раствора серной кислоты (плотность раствора, r = 1,10 г/см3).
Решение. Найдем массу 100 мл 15%-ного (по массе) раствора Н2SO4.
mраствора = r×V = 1,10×100 = 110 г
Массу Н2SO4 , содержащуюся в 110 г этого раствора, найдем из пропорции
100 г раствора содержат 15 г Н2SO4
110 г раствора » х г Н2SO4,
х =16,5 г Н2SO4
или m 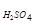 = 110×
= 110× 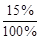 = 16,5 г.
= 16,5 г.
Далее найдем массу 96 %-ного (по массе) раствора Н2SO4, в котором содержится 16,5 г Н2SO4,
в 100 г раствора содержится 96 г Н2SO4
х г » » 16,5 г Н2SO4 ;
х = 17,2 г раствора или m 96%-ного р-ра = 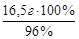 = 17,2 г. Найдем объем 96 %-ного раствора, масса которого 17,2 г:
= 17,2 г. Найдем объем 96 %-ного раствора, масса которого 17,2 г:
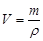 ; V = 17,2/1,84 = 9,34 мл.
; V = 17,2/1,84 = 9,34 мл.
Итак, для приготовления 100 мл 15%-ного раствора Н2SO4 потребуется 9,34 мл 96%-ного раствора и 110 г - 16,5 г = 93,5 г Н2О.
Задача 3. Определите молярную концентрацию раствора NaOH, если в 200 мл раствора содержится 1,6 г растворенного вещества.
Решение. Молярная масса NaOH равна 40 г/моль. Определим количество молей NaOH, содержащихся в 200 мл раствора:
n = 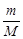 = 1,6 : 40 = 0,04 моля.
= 1,6 : 40 = 0,04 моля.
Исходя из определения молярной концентрации, найдем количество молей NaOH, содержащихся в 1 л раствора:
СM = n / V
СM = 0,04 : 0,2 = 0,2 моль/л.
Задача 4. Какова нормальность раствора хлорида железа (III), в 0,3 л которого содержится 32,44 г соли?
Решение. Молярная масса хлорида железа равна 162,3 г/моль. Эквивалентная масса FeCl3 = 162,3 : 3 = 54,1 г/моль-экв.
Определим количество моль-эквивалентов растворенного вещества (FeCl3), содержащихся в 0,3 л раствора:
n = 32,44 : 54,1 = 0,6 моль-эквивалентов (эквивалентов).
Нормальность определяется количеством моль-эквивалентов растворенного вещества в 1 л раствора. Следовательно, 0,3 л содержит 0,6 моль-эквивалента
1 л » х моль-эквивалентов;
х = 2 моль-эквивалента (эквивалента).
СН = 2 (2н раствор) или СН = 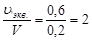 экв./л.
экв./л.
Задача 5. Определите молярность, нормальность и титр 15%-ного раствора серной кислоты. Плотность раствора r =1,10 г/см3.
Решение. 1. Примем объем раствора, равным 1 л. Определяем массу (г) серной кислоты, содержащуюся в 1 л ее раствора, из пропорции
в 100 г раствора содержится 15 г Н2SO4
в 1,10 × 1000 г » » х г Н2SO4 ,
отсюда следует, что в 1л раствора массой 1,10 × 1000 г содержится х =165 г Н2SO4 ;
2.Молярная масса Н2SO4 равна 98 г/моль, в 1л раствора содержится Н2SO4 165 : 98 = 1,68 моль. Таким образом СМ = 1,68 моль/л;
3.Эквивалент Н2SO4 равен 98 : 2 = 49 г/моль-экв. или 49 г/экв. Количество моль-эквивалентов в165 г Н2SO4 равно 165 : 49 = 3,36 моль-эквивалентов. Следовательно, в 1л раствора содержится 3,36 моль-эквивалентов
СН = 3,36 моль-экв./л (экв./л);
4.Определим титр раствора. Т = m / v; Т = 165: 1000 = 0,165 г/мл.
Задача 6. В каком объеме 0,5 нормального раствора карбоната натрия содержится 10 г соли? Какова молярность и титр этого раствора?
Решение. 1.Исходя из определения нормальности, в 1 литре раствора содержится 0,5 моль-эквивалентов Na2CO3.
Эквивалентная масса Na2CO3 = 106 : 2 = 53 г/моль-экв. Следовательно, в 1 л 0,5 н раствора содержится 0,5 × 53 = 26,5 г Na2CO3,
тогда в 1л 0,5н раствора содержится 26,5 г Na2CO3
в х л » 10 г Na2CO3
х = 0,38 л ;
2.Определим СМ раствора. В 1 л 0,5н раствора содержится 26,5 г Na2CO3. Находим количество молей Na2CO3
n = 26,5:106=0,25 молей, следовательно, СМ = 0,25 моль/л.
3.Определим титр раствора.
В 1000 мл раствора содержится 26,5 г Na2CO3
в 1мл раствора » х г
х = 0,0265 г, Т = 0,0265 г/мл.
Задача 7. Для нейтрализации 42 мл серной кислоты потребовалось 14 мл 0,3 н раствора щелочи. Определите молярность раствора Н2SO4.
Решение. Поскольку вещества реагируют между собой в эквивалентных количествах (закон эквивалентов), то можно написать
CН кислоты× Vкислоты = CН щелочи× Vщелочи
Следовательно, CН кислоты × 42 = 14 × 0,3; CН кислоты = 0,1.
CН кислоты = 0,1 моль-эквивалентов/л. Молярная масса Н2SO4 = 98 г/моль; эквивалентная масса Н2SO4 =98 : 2 = 49 г/моль-экв., или эквивалентная масса составляет 0,5 моля Н2SO4.
Отсюда молярность раствора Н2SO4 составит 0,1 × 0,5 = 0,05 моль/л, CМ = 0,05 моль/л.
Или примем Vх раствора = 1 л, тогда m 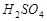 = CН × Э × V;
= CН × Э × V;
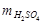 = 0,1×49×1 = 4,9 г; CМ =
= 0,1×49×1 = 4,9 г; CМ = 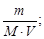
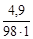 = 0,05 моль/л.
= 0,05 моль/л.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
Теоретические вопросы
1. Растворы (определение). Почему для характеристики растворов, в отличие от индивидуальных веществ, необходимо указывать их состав?
2. Назовите известные Вам способы выражения состава растворов (концентрации). Укажите единицы их измерения.
3. Приведите формулы для расчета концентраций растворов (w, СМ, СН, Т).
4. Приведите примеры жидких, твердых и газообразных (газовых смесей) растворов. Какой из компонентов раствора обычно выбирают в качестве растворителя?
5. Какие растворы называются ненасыщенными, насыщенными и пересыщенными? Концентрация какого из этих растворов называется растворимостью?
6. Какова зависимость растворимости газов в жидкостях от температуры и давления (закон Генри)? Что такое парциальное давление?
7. Какова зависимость растворимости кристаллического вещества от температуры? Перекристаллизация и ее практическое применение.
8. Сольватация (гидратация) и ее роль в процессе образования растворов. Сольватная (гидратная) оболочка.
9. Энтальпия растворения как результат соотношения энтальпии разрушения кристаллической решетки и энтальпии сольватации (гидратации).
10. Дайте определения понятиям «массовая доля растворенного вещества в растворе» и «молярная концентрация раствора». Укажите расчетные формулы, единицы измерения.
11. Дайте определения понятиям «нормальная концентрация раствора» и «титр раствора». Укажите расчетные формулы, единицы измерения.
12. Применение принципа Ле-Шателье к обратимой системе «газ + растворитель D раствор»; rН > 0. Как влияет изменение давления газа и температуры на растворимость газа в жидкости?
13. Применение принципа Ле-Шателье к обратимой системе «кристаллическое вещество + растворитель D раствор»; rН < 0. Как влияет изменение температуры и внешнего давления на растворимость твердого вещества в жидкости?
14. Одинаковы ли энтальпии растворения Na2SO4 и Na2SO4 × 10 Н2О? Почему?
Задачи
1. Сколько граммов сульфата натрия следует растворить в 400 мл воды для получения 8%-ного (по массе) раствора?
2. Вычислите массовую долю (w %) раствора, содержащего 50 г хлорида натрия в 650 г воды.
3. Какова массовая доля (w %) раствора, если в 750 мл воды содержится 60 г нитрата серебра?
4. В каком количестве молей воды следует растворить 40 г иодида калия для получения 4%-ного (по массе) раствора?
5. В каком объеме воды следует растворить 50 г хлорида калия для получения 10%-ного (по массе) раствора?
6. Сколько граммов хлористого водорода надо растворить в 250 мл воды для получения 10%-ного (по массе) раствора соляной кислоты?
7. В 150 граммах воды растворили 15 л хлористого водорода (н.у.). Определите массовую долю (w %) образовавшегося раствора соляной кислоты.
8. Какой объем газообразного аммиака (н.у.) надо растворить в воде, чтобы получить 500 г 6%-ного (по массе) раствора аммиака?
9. Сколько граммов гидроксида калия надо растворить в 100 г воды, чтобы получить раствор с массовой долей 6 %.
10. Сколько граммов соли и воды содержится в 800 г 12%-ного (по массе) раствора нитрата натрия?
11. К 300 мл раствора с массовой долей серной кислоты 30 % (плотность раствора r = 1,22 г/мл) добавим 1 литр воды. Рассчитайте массовую долю (w %) полученного раствора.
12. В каком объеме воды следует растворить 100 граммов сульфата калия для получения раствора с массовой долей растворенного вещества 5 %?
13. Сколько граммов хлорида натрия и воды потребуется для приготовления 3 л раствора с массовой долей растворенного вещества 5 % (плотность раствора r = 1,03 г/мл)?
14. В каком объеме воды следует растворить 60 г хлорида магния для получения 10%-ного (по массе) раствора?
15. Вычислите массовую долю (w %) раствора, содержащего 50 г сульфата натрия в 750 г воды.
16. Вычислите массовую долю (w %) азотной кислоты в растворе, в 0,5 л которого содержится 120 г кислоты.
17. Какой объем 96%-ной (по массе) серной кислоты (плотность раствора r = 1,84 г/мл) потребуется для приготовления 3 л 0,5 М раствора? Какова нормальность полученного раствора?
18. Рассчитайте молярность, нормальность и титр 2 % -ного раствора сульфата магния (плотность раствора r = 1,02 г/мл).
19. Рассчитайте молярную и нормальную концентрацию 8%-ного (по массе) раствора серной кислоты (плотность раствора r = 1,05 г/мл).
20. В 282 мл воды растворим 18 г фосфорной кислоты. Рассчитайте масссовую долю (w %), молярность и нормальность этого раствора (плотность раствора r = 1,03 г/мл).
21. Сколько граммов сульфата калия необходимо для приготовления 5 л раствора с массовой долей 5 % (плотность раствора r = 1,04 г/мл)? Рассчитайте молярность и нормальность приготовленного раствора.
22. В каком объеме 0,5 молярного раствора карбоната натрия содержится 7 граммов соли? Какова нормальность и титр этого раствора?
23. К раствору серной кислоты объемом 300 мл с массовой долей 30 % (плотность раствора r = 1,22 г/мл) добавили 1 л воды. Рассчитайте массовую долю (w %) и молярность полученного раствора.
24. Сколько миллилитров 96%-ного раствора серной кислоты (плотность раствора r = 1,84 г/мл) необходимо для приготовления 2 л 0,5 нормального раствора серной кислоты?
25. В 33,3 мл воды растворили 16,7 грамма серной кислоты. Рассчитайте массовую долю (w %), молярность, нормальность и титр полученного раствора (плотность раствора r = 1,28 г/мл).
26. Сколько граммов нитрата калия потребуется для приготовления 500 мл 0,23 молярного раствора? Какова молярность и титр полученного раствора?
27. Титр раствора хлорида кальция равен 0,022 г/мл. Рассчитайте молярность и нормальность этого раствора.
28. Сколько граммов соли содержится в 200 мл 0,3 нормального раствора хлорида алюминия? Какова молярность и титр этого раствора?
29. Сколько литров 0,5 молярного раствора серной кислоты можно приготовить из 70 мл 50%-ного (по массе) раствора серной кислоты (плотность раствора r = 1,40 г/мл)?
30. Вычислите массовую долю (w %) раствора азотной кислоты в 0,3 л которого содержится 100 г кислоты (плотность раствора r = 1,28 г/мл). Какова молярность и нормальность этого раствора?
31. Сколько граммов раствора с массовой долей хлорида бария 4 % потребуется для взаимодействия с 30 мл 0,5 нормального раствора серной кислоты?
32. Сколько миллилитров 0,5 нормального раствора серной кислоты потребуется для нейтрализации 20 граммов гидроксида натрия?
33. Какой объем водорода (н.у.) выделится при растворении цинка в 100 мл 20%-ного (по массе) раствора соляной кислоты (плотность раствора r = 1,10 г/мл)?
34. Какой объем 0,2 молярного раствора серной кислоты потребуется для нейтрализации гидроксида калия, содержащегося в 300 г 17%-ного (по массе) раствора?
35. Сколько граммов раствора с массовой долей нитрата серебра 2% потребуется для взаимодействия с 30 мл 0,5 нормального раствора соляной кислоты?
36. Сколько миллилитров 0,5 нормального раствора соляной кислоты необходимо добавить к раствору нитрата серебра для получения 0,3 грамма осадка?
37. Сколько миллилитров 23%-ного (по массе) раствора аммиака (плотность раствора r = 0,916 г/мл) потребуется для взаимодействия с 250 мл 2 нормального раствора соляной кислоты?
38. Сколько литров 0,1 нормального раствора нитрата серебра потребуется для взаимодействия с 0,5 л 0,3 нормального раствора хлорида алюминия?
39. Какой объем 0,25 нормального раствора серной кислоты потребуется добавить к раствору карбоната натрия, чтобы выделилось 8 л диоксида углерода (н.у.)?
40. Сколько граммов 5%-ного раствора нитрата серебра потребуется для взаимодействия со 120 мл 0,5 нормального раствора хлорида магния?
