Оптические (спектральные) методы анализа
Физико-химические методы анализа
Основные вопросы:
- Классификация физико-химических методов анализа.
- Оптические методы анализа.
- Электрохимические методы анализа.
- Хроматографические методы анализа.
Физико-химические методы анализа (инструментальные методы) – отдельный раздел аналитической химии, заданием которого является определение количественного и качественного состава веществ при изменении их физико-химических свойств.
Преимущества физико-химических методов анализа:
ü скорость определения;
ü высокая чувствительность; высокая избирательность;
ü возможность непрерывного выполнения анализов;
ü возможность широкого применения компьютерных баз данных и программного обеспечения.
Задачи, решаемые с помощью физико-химических методов анализа:
1. Определение качества сырья.
2. Контроль процессов производства.
3. Анализ отходов производства с целью их утилизации и охрана окружающей среды.
4. Контроль качества произведённой продукции.
5. Определение в сырье и в продовольственных и непродовольственных товарах предельно допустимых концентраций (ПДК) токсических веществ (Нg, Pb, Cd, канцерогенные соединения, ароматические углеводороды, N- нитрозоамины).
Физико-химические методы– это методы анализа, которые основываются на зависимости физической характеристики веществ (светопоглощения, светопреломления, электрической проводимости, теплопроводности) от их химического состава. Интенсивность физического сигнала зависит от концентрации исследуемого компонента. Измерения проводят с помощью соответствующей аппаратуры (инструментальные методы).
Аналитический сигнал – любое проявление химических и физических свойств объекта анализа, которое можно использовать для количественной и качественной оценки компонентов вещества.

Количественное определение физико-химическим методом состоит из следующих этапов:
1. приготовление стандартных растворов разных концентраций (серия растворов);
2. количественная оценка (при помощи специального прибора) какого-либо физического свойства для всех приготовленных растворов;
3. построение калибровочного графика в координатах состав – свойство. Обычно на оси абсцисс откладывают концентрацию вещества, а на оси ординат – значение измеряемого свойства;
4. определение количественных характеристик свойства при помощи прибора;
5. определение по калибровочному графику концентрации исследуемого вещества.
Оптические (спектральные) методы анализа
Суть метода основывается на взаимодействии вещества со средой, а в качестве среды имеют электромагнитные волны оптического диапазона. В результате взаимодействия происходит изменение свойств веществ, вступивших в реакцию.
Оптические (спектральные) методы анализа базируются на использовании разных явлений и эффектов, возникающих при взаимодействии вещества и электромагнитного излучения (изучении спектров поглощения, излучения и рассеивания).
Оптический спектрсодержит ультрафиолетовую (УФ), видимую и инфракрасную (ИК) области.
При взаимодействии вещества с электромагнитными волнами можно зафиксировать такие изменения.
1. Поглощение света веществом, поглощать свет могут молекулы и ионы (фотометрический анализ):
колориметрия;
фотоколориметрия;
спектрофотометрия (используется весь диапазон) – получают спектр вещества.
Совокупность методов молекулярно-абсорбционного спектрального анализа, основанных на избирательном поглощении электромагнитного излучения в видимой, ИК и УФ областях молекулами определяемого компонента или его соединений с подходящим реагентом.
2. Поглощение света атомами вещества – атомно-абсорбционный метод:
3. Излучение веществ, находящихся в состоянии плазмы (высокая температура):
¯ эмиссионный метод;
¯ флюорометрия;
¯ люминесцентный метод.
4. Излучение отдельных атомов, когда вещество переходит в состояние плазмы (800 – 50000С):
© эмиссионный спектральный анализ;
© плазменная фотометрия.
Важной характеристикой любого метода является предел чувствительности (предел обнаружения вещества в граммах).
ü При фотометрии ‑ 1·10-6 г;
ü При флюорометрии (люминесцентные методы) ‑ 1·10-10 г;
ü При полярографии ‑ 1·10-8 г;
ü При эмиссионном спектральном анализе ‑ 1·10-10 г;
 Основой фотометрического метода анализа является избирательное поглощение света частицами (молекулами или ионами) вещества в растворе.
Основой фотометрического метода анализа является избирательное поглощение света частицами (молекулами или ионами) вещества в растворе.
 Фотометрический анализ включает визуальную колориметрию (колориметрию), спектрофотометрию и фотоколориметрию.
Фотометрический анализ включает визуальную колориметрию (колориметрию), спектрофотометрию и фотоколориметрию.
 Характер поглощения зависит от природы вещества – на этом строится качественный анализ, а на зависимости светопоглощения от концентрации основывается количественный анализ веществ.
Характер поглощения зависит от природы вещества – на этом строится качественный анализ, а на зависимости светопоглощения от концентрации основывается количественный анализ веществ.
 Колориметрические (фотометрические) методы анализа базируются на реакциях, сопровождающихся образованием растворимых соединений (иногда разрушением окрашенных соединений).
Колориметрические (фотометрические) методы анализа базируются на реакциях, сопровождающихся образованием растворимых соединений (иногда разрушением окрашенных соединений).
 Количественная оценка поглощения света измеряется светопоглощением (А), светопропусканием (Т) и оптической плотностью (D).
Количественная оценка поглощения света измеряется светопоглощением (А), светопропусканием (Т) и оптической плотностью (D).
 Основные оптические характеристики окрашенного раствора:окраскаиинтенсивностьэтойокраски.
Основные оптические характеристики окрашенного раствора:окраскаиинтенсивностьэтойокраски.
 Окраска любого раствора характеризуется спектром поглощения. О количестве исследуемого компонента судят по интенсивности окрашивания раствора (чем интенсивнее окраска, тем больше концентрация элемента в растворе).
Окраска любого раствора характеризуется спектром поглощения. О количестве исследуемого компонента судят по интенсивности окрашивания раствора (чем интенсивнее окраска, тем больше концентрация элемента в растворе).
 За меру интенсивности окраски принимают оптическую плотность D.
За меру интенсивности окраски принимают оптическую плотность D.
lg 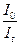 ‑ оптическая плотность – характеризует степень ослабления (поглощения) света при прохождении его через раствор.
‑ оптическая плотность – характеризует степень ослабления (поглощения) света при прохождении его через раствор.
 Растворы одного и того же окрашенного вещества при одинаковой концентрации вещества и толщине слоя раствора поглощают равное количество световой энергии (светопоглощение таких растворов одинаковое).
Растворы одного и того же окрашенного вещества при одинаковой концентрации вещества и толщине слоя раствора поглощают равное количество световой энергии (светопоглощение таких растворов одинаковое).
Если исследуемый раствор подчиняется закону Бугера – Ламберта – Бера наблюдается прямая пропорциональная зависимость.
D=f(C) при постоянной толщине поглощающего слоя.
 Интенсивность окраски связана с интенсивностью поглощения света.
Интенсивность окраски связана с интенсивностью поглощения света.
Интенсивность поглощения света зависит от:
▪ концентрации окрашенного соединения в растворе;
▪ толщины поглощающего слоя.
lg 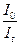 =E
=E 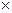 L × C,где
L × C,где
І0 – интенсивность потока света, входящего в раствор;
Іt – интенсивность света, прошедшего через раствор;
L – толщина поглощающего света;
С – концентрация окрашенного соединения в растворе (моль/л);
Е – молярный коэффициент поглощения („Епсилон”).
Физическая суть Е: молярный коэффициент поглощения численно равен оптической плотности 1М раствора при толщине поглощающего слоя 1см. Характеризует внутренние свойства вещества и не зависит от объёма раствора, толщины слоя, интенсивности освещения; является наиболее важной характеристикой возможной чувствительности фотометрического определения.
D= Е × L × С
закон Бугера – Ламберта – Бера (основный закон светопоглощения).
Выполняется при условии: L >> λ; С – не очень большая.
Формулировка закона Бугера – Ламберта ‑ Бера: Оптическая плотность растворов пропорциональна произведению концентрацию окрашенного вещества и толщине поглощающего слоя.
 Количественное определение вещества по светопоглощению основывается на использовании закона Бугера – Ламберта – Бера. Оптическую плотность исследуемого раствора измеряют с помощью фотоэлектроколориметра или спектрофотометра, а потом расчётным или графическим способом находят концентрацию. Последние две операции на современных приборах выполняют компьютеры.
Количественное определение вещества по светопоглощению основывается на использовании закона Бугера – Ламберта – Бера. Оптическую плотность исследуемого раствора измеряют с помощью фотоэлектроколориметра или спектрофотометра, а потом расчётным или графическим способом находят концентрацию. Последние две операции на современных приборах выполняют компьютеры.
 В фотоколориметрии поглощение света измеряют в видимой области спектра, реже – в ближних УФ и ИК областях (т.е. в интервале длин волн от 315 – 980 нм), для выделения нужного участка спектра (шириной 10…100нм) используют узкополосные светофильтры. Приборами служат фотоэлектроколориметры (ФЭК, КФК).
В фотоколориметрии поглощение света измеряют в видимой области спектра, реже – в ближних УФ и ИК областях (т.е. в интервале длин волн от 315 – 980 нм), для выделения нужного участка спектра (шириной 10…100нм) используют узкополосные светофильтры. Приборами служат фотоэлектроколориметры (ФЭК, КФК).
Измеряемый диапазон оптической плотности составляет от 0,05 до 3,0, что позволяет определять многие элементы и их соединения в широком интервале содержаний от 10-6 до 50% по массе.
 Спектрофотомерия базируется на основе измерения поглощения монохроматического излучения УФ, видимой и ИК области спектра. Такие измерения проводят с помощью спектрофотометров. Спектрофотометры имеют более сложную конструкцию и часто – электронные устройства (усилители фототока, дисплее).
Спектрофотомерия базируется на основе измерения поглощения монохроматического излучения УФ, видимой и ИК области спектра. Такие измерения проводят с помощью спектрофотометров. Спектрофотометры имеют более сложную конструкцию и часто – электронные устройства (усилители фототока, дисплее).
 |  |  |  |  |
Каждый спектральный прибор включает:
1. источник излучения;
2. фокусирующее устройство;
3. устройство для выделения необходимого интервала длин волн (монохроматор или светофильтр);
Светофильтры – стёкла, способные пропускать свет лишь определённой длины волны. При этом другой свет ими поглощается.
4. кюветное отделение;
Кюветы – посуда прямоугольной формы для спектрофотометрических исследований. Кюветы бывают: стеклянные – для исследований растворов в видимой области спектра (350 – 700нм), кварцевые – для диапазона ультрафиолетового и видимого спектров (200 – 700 нм).
При работе с инфракрасными лучами (700 нм и больше) используют кюветы со стенками из плавленого хлорида серебра или вместо растворов используют таблетки из этих веществ с бромидом калия. Кюветы бывают прямоугольные, термостатированные, проточные, цилиндрические.
Кювета с исследуемым раствором называется рабочая кювета, а кювета с раствором сравнения – кювета сравнения; обе кюветы должны быть идентичными.
Основное требование к кюветам – прозрачность в области спектра, в котором проводится измерение оптической плотности. Для работы в видимой области спектра кюветы изготавливают из стекла, а в ультрафиолетовой – из кремния.
 |  |  |  |
5. детектор, преобразователь сигнала;
6. индикатор сигнала (шкала или компьютерный дисплей).
В фотоэлектроколориметрии степень поглощения света (интенсивность окраски раствора) определяют с помощью фотоэлемента.
Фотоэлемент ‑ металлическая пластинка, покрытая слоем полупроводника (селен, сульфид свинца).
Световой поток после попадания на фотоэлемент, возбуждает в нём электрический ток. Величина возникшего фототока прямо пропорциональна падающему световому потоку (закон Столетова). Возникший электрический ток регистрируется включением в цепь чувствительным микроамперметром, отклонение стрелки которого прямо пропорционально освещённости фотоэлемента.
В зависимости от количества фотоэлементов, используемых при измерении, различают:
1. фотоэлектроколориметры с одним фотоэлементом (однолучевые приборы);
2. фотоэлектроколориметры с двумя фотоэлементами (двулучевые приборы). Чаще всего используют ФЕК-М; ФЕК-56М; ФЕК-Н-57, МКФМ-02.
Этапы колориметрического (фотоэлектроколориметрического) определения
І этап. Исследуемый компонент с помощью химической реакции переводят в окрашенное соединение:
X + R → П
где Х – исследуемый компонент; R – реагент; П – продукт (окрашенное соединение).
ІІ этап. Измеряют интенсивность окрашивания раствора
Окрашивание исследуемого раствора сравнивают с окрашиванием стандартного раствора (с точно определённой концентрацией исследуемого компонента).
В зависимости от способа измерения интенсивности окраски методы:
 Визуальные методы;
Визуальные методы;
 Инструментальные методы.
Инструментальные методы.
Визуальные методы
▪ Визуальная колориметрия (стараются достичь одинаковой интенсивности окрашивания исследуемого и стандартного растворов, сравнение происходит визуально).
Преимущества: простота, быстрота выполнения.
Недостатки:
ü относительная ошибка определений – от 2 до 10%;
ü точность определений зависит от индивидуальной способности улавливать разницу в интенсивностях окраски.
Условия сравнения интенсивности окраски:
³ реактивы добавляют в одинаковой последовательности и количествах;
³ если в исследуемом растворе содержатся посторонние ионы, влияющие на окраску, то к стандартному раствору добавляют эти ионы и в тех же количествах;
³ окраску растворов сравнивают в одинаковых посудах.
Методы визуальной колориметрии:
þ Метод стандартных серий(готовят колориметрическую шкалу ‑ ряд растворов с известной концентрацией исследуемого вещества).
Сравнивают окрашивание исследуемого раствора с окрашиванием серии стандартных растворов (концентрация исследуемого раствора равна концентрации стандартного раствора одинаковой интенсивности окраски).
Используют при массовых анализах растворов, если окраска растворов устойчивая во времени.
þ Метод колориметрического титрования(проводят в 2-х цилиндрах)
І цилиндр: Исследуемый раствор + реактивы → окрашенный раствор.
ІІ цилиндр: Н2О + реактивы + стандартный раствор из бюретки → окрашенный раствор.
m(вещества) = 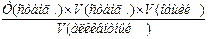
Основное требование: мгновенное появление окраски.
þ Метод разбавления(готовят 1 стандартный раствор)
Сравнивают интенсивность окраски исследуемого и стандартного растворов способом разбавления водой раствора с более интенсивной окраской. Используют градуированные цилиндры.
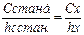 ,
,
где hх – та hстанд. ‑ высота жидкости в исследуемом и стандартном растворах после разбавления.
Применяют для растворов близких по интенсивностям окраски.
