Основное уравнение молекулярно-кинетической теории идеальных газов
Рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку ΔS и вычислим давление на эту площадку. При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей импульс m0υ -(- m0υ) = 2m0υ,
где: т0- масса молекулы, υ - ее скорость.
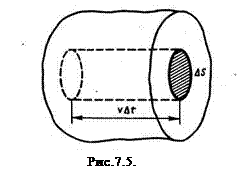 За время Δt площадки ΔS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием ΔS и высотой υΔt. Число этих молекул равно nΔSυΔt (n - концентрация молекул).
За время Δt площадки ΔS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием ΔS и высотой υΔt. Число этих молекул равно nΔSυΔt (n - концентрация молекул).
Необходимо учитывать, что реально молекулы движутся к площадке ΔS под разными углами и имеют различные скорости, причем скорость молекул при каждом соударении меняется. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина молекул, т.е. 1/6 часть, движется вдоль данного направления в одну сторону, половина — в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку ΔS будет 1/6 nΔSυΔt. При столкновении с площадкой эти молекулы передадут ей импульс
ΔP=2m0υ∙ 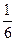 nΔSυΔt =
nΔSυΔt = 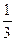 nm0υ2 ΔSΔt.
nm0υ2 ΔSΔt.
Тогда давление газа, оказываемое им на стенку сосуда,
p=ΔΡ/(ΔSΔt)= 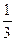 nm0υ2 . (7.12)
nm0υ2 . (7.12)
Если газ в объеме V содержит N молекул, движущихся со скоростями υ1, υ2,..., υN, то целесообразно рассматривать среднюю квадратную скорость
υcк= 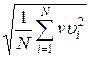 (7.13)
(7.13)
характеризующую всю совокупность молекул газа. Уравнение (3.1) с учетом (3.2) примет вид
p= 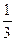 nm0υcк2. (7.14)
nm0υcк2. (7.14)
Выражение (7.14) называется основным уравнением молекулярно-кинетической теории идеальных газов.
Учитывая, что n=N/V,получим
pV= 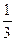 Nm0υcк2,
Nm0υcк2,
или
pV= 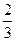 N
N 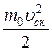 =
= 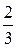 W, (7.15)
W, (7.15)
где W — суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m=Nm0, то уравнение (7.14) можно переписать в виде
pV= 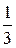 mυcк2.
mυcк2.
Для одного моля газа т=М (М — молярная масса), поэтому
pVm= 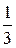 Mυcк2,
Mυcк2,
где Vm — молярный объем. С другой стороны, по уравнению Клапейрона - Менделеева, pVm=RT. Таким образом,
RT = 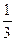 Mυcк2
Mυcк2
откуда
υcк = 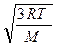 . (7.16)
. (7.16)
Так как
М= NА m0,
где m0 — масса одной молекулы, а NА — постоянная Авогадро, то из уравнения (7.16) следует, что
υcк= 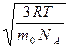 =
= 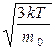 , (7.17)
, (7.17)
где: k=R/NA — постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют υcк =480 м/с, водорода – 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
<w0> = 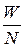 =
= 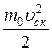 =
= 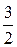 kТ (7.18)
kТ (7.18)
пропорциональна термодинамической температуре и зависит только от нее. Из этого уравнения следует, что при N=0 имеем <w0>=0, т. е. при 0 К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа, и формула (7.18) раскрывает молекулярно-кинетическое толкование температуры.
