Подставив в (2) все известные величины, мы получим значение
R0 = 8314 Дж/(кмоль К).
Другой известный закон Авогадро гласит, что в одном киломоле любого вещества содержится одинаковое количество структурных единиц (молекул, атомов). Это число называется числом Авогадро: NA = 6,02 1026 кмоль-1.
Тогда в уравнении (2) количество киломолей nm можно выразить через общее количество молекул N : nm = N/ NA. При подстановке в (2) получим:
PV = (N/ NA )R0T. Величина R0/ NA =k = 1,38 10-23 Дж/К – новая константа, называемая постоянной Больцмана. С учетом того, что величина N/V = n – концентрация частиц в объеме V, уравнение состояния можно записать в виде
P = n k T. (3)
Таким образом, постоянная Больцмана устанавливает связь между термодинамическим и молекулярно-кинетическим подходами к изучению состояний систем.
Лекция №2
Смеси идеальных газов. Первое начало термодинамики.
1. Смеси идеальных газов.
Пусть газ представляет собой не реагирующую смесь из нескольких компонент. Как будет выглядеть уравнение состояния такого газа? Существуют два подхода к рассмотрению таких систем: массовый и объемный состав смеси.
Рассмотрим массовый состав смеси: mсм = ∑mi и введем массовую долю газовой компоненты gi = mi/mсм; ∑ gi = 1. Введем также понятие парциального давления Рi : это давление, которое оказывала бы i-тая компонента газа, если бы она одна занимала весь объем смеси при температуре смеси. Для давления смеси существует закон Дальтона: Рсм = ∑ Рi. Это утверждение легко проверить, если воспользоваться уравнением состояния для смеси в виде (3), представив количество молекул в смеси в виде суммы молекул отдельных компонент и соответственно концентрацию смеси в виде суммы их концентраций. Чему же равна газовая постоянная смеси Rсм? Для вывода Rсм запишем уравнения:
PсмVсм = mсмRсмTсм, (4)
Рi Vсм = mi Ri Tсм (5)
Просуммируем уравнения (5) по всем i и сравним с (4). Левые части этих уравнений оказались равными, тогда из равенства правых частей получим:
mсмRсм = ∑ mi Ri , (6)
откуда Rсм = ∑ mi / mсм Ri =∑ gi Ri = R0 ∑ gi /mi . (7)
Рассмотрим объемный состав смеси. Парциальный объем Vi – это объем, который имела бы i-тая компонента смеси при Р = Рсм и Т = Тсм. Таким образом, можем записать
РсмVi = miRiTсм (8)
Сравнив это выражение с (5), получим РсмVi = Рi Vсм, откуда следует:
Pi = Pcмri , где ri = Vi/Vсм – объемная доля смеси.
Найдем молекулярную массу смеси. Для этого уравнения (4) и (8) перепишем в виде:
PсмVсм = mсм /μсм R0Tсм, (9)
РсмVi = mi /μiR0Tсм (10)
(10) разделим на (9) и проведем суммирование по всем индексам. Легко видеть, что μсм = ∑ μi ri (11).
Теперь осталось установить связь между массовой и объемной долями компонентов смеси.
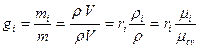 (12)
(12)
Полученных формул достаточно для рассмотрения свойств газовых смесей.
2. Первое начало термодинамики.
Первое начало, или первый закон, термодинамики представляет собой закон сохранения энергии в применении к тепловым процессам. Необходимо ввести понятие внутренней энергии термодинамической системы. Внутренняя энергия U термодинамической системы есть суммарная полная энергия составляющих ее частиц. Для газа это сумма кинетических энергий всех молекул плюс энергия взаимодействия молекул между собой (движения системы как целого мы не рассматриваем и потенциальную энергию системы в поле тяжести Земли считаем равной нулю). Если не делать предположения об идеальности газа, то внутренняя энергия есть функция двух параметров состояния: температуры Т (т.к. средняя кинетическая энергия молекул зависит от температуры газа) и объема V, так как энергия взаимодействия молекул зависит от их взаимных расстояний. Поскольку для идеального газа энергией взаимодействия молекул мы пренебрегаем, то для него U = U(T) – является функцией только температуры.
Если хотя бы один из параметров состояния системы изменяется, то в системе совершается термодинамический процесс, в результате которого она переходит в новое состояние. Какие воздействия на систему могут вызвать такой переход? Существует два способа передачи энергии системе, в результате чего она переходит в новое состояние: сообщение системе некоторого количества теплоты и совершение над системой работы.
Сообщение системе тепла связано с понятием теплоемкость. Теплоемкостью С[Дж/К] называют величину, равную количеству теплоты, которое надо сообщить телу, чтобы повысить его температуру на один градус. Если рассчитать это количество теплоты на единицу массы тела, то получим удельную теплоемкость с [Дж/кгК]. Тогда количество тепла, сообщенное системе, можно вычислить по формуле: dQ = mcDT (в том случае, если с = const). Для газов оказывается, что для повышения температуры на одну и ту же величину DT требуется сообщить различное количество теплоты в зависимости от процесса, в котором эта теплота сообщается. Поэтому существует два вида теплоемкости: теплоемкость при постоянном объеме cv и теплоемкость при постоянном давлении ср. Различие между ними станет ясным из дальнейшего изложения.
Работу, совершаемую газом при расширении (или производимую над ним при сжатии), легко рассчитать, рассматривая расширение газа в цилиндре с поперечным сечением S под поршнем: dА =Fdx =PSdx =PdV. Равновесное состояние газа часто изображают графически на диаграмме PV в виде точки на плоскости, а процесс перехода из одного состояния в другое – в виде кривой, или графика, процесса. Тогда работу, произведенную в процессе, графически можно изобразить в виде площади под этой кривой: 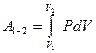 .
.
P
 | ||
 |
V
Давление Р в этой формуле нужно рассматривать как функцию объема V.
Теперь можем сформулировать первое начало термодинамики как закон сохранения энергии в тепловых процессах: тепловая энергия, подведенная к термодинамической системе, расходуется на изменение ее внутренней энергии и на работу, производимую системой против внешних сил.
В термодинамике часто рассматриваются термодинамические циклы, т.е. процессы, в результате которых система возвращается в исходное состояние.
Первое начало утверждает, что если система совершает термодинамический цикл, то полное количество теплоты, сообщенное системе, равно совершенной ею работе. Математическая формулировка первого начала:
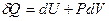 (13)
(13)
Все величины в формуле (13) могут быть рассчитаны на единицу массы системы. Тогда вместо (13) имеем:
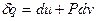 , (14)
, (14)
где v – удельный объем.
Для идеального газа внутренняя энергия системы является функцией только состояния газа, ее изменение в термодинамическом процессе не зависит от типа процесса, а зависит только от состояния, в которое перешла система. Поэтому dU (du) является полным дифференциалом. В отличие от внутренней энергии работа (это хорошо видно на диаграмме), как и теплота являются функциями процесса. Поэтому выражения dQ, dA полными дифференциалами не являются.
Полный дифференциал внутренней энергии газа в общем случае может быть записан как
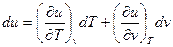 (15)
(15)
Чему равна величина первого члена в правой части формулы? Допустим, что мы применили первое начало (14) к изохорному процессу (V=const.). Из (14) следует, что 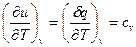 , и удельная теплоемкость при постоянном объеме характеризует темп роста внутренней энергии с температурой. Для идеального газа (пренебрегаем взаимодействием молекул) второй член в (15) отсутствует, т.е.
, и удельная теплоемкость при постоянном объеме характеризует темп роста внутренней энергии с температурой. Для идеального газа (пренебрегаем взаимодействием молекул) второй член в (15) отсутствует, т.е. 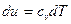 . Таким образом, уравнение первого начала для идеального газа записывается в виде:
. Таким образом, уравнение первого начала для идеального газа записывается в виде:
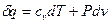 (16)
(16)
Внутренняя энергия является термодинамической функцией состояния системы. Существуют и другие функции состояния; одной из них является
энтальпия (ее называют также теплосодержанием). Вернемся к формуле (14) для первого начала термодинамики. Заметим, что Pdv =d(Pv) – vdP, и подставим это выражение в формулу:
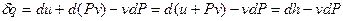 , (17)
, (17)
где функция h = u +Pv – удельная энтальпия системы. Как и внутренняя энергия, энтальпия для идеального газа является функцией только температуры системы. Уравнение (17) есть вторая форма записи первого закона термодинамики – через энтальпию. В общем случае принято считать, что энтальпия является функцией температуры и давления системы. Тогда полный дифференциал энтальпии в общем случае можно записать как:
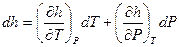 (18)
(18)
Что такое 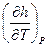 ? Применим уравнение (17) к изобарному (Р = const) процессу. Тогда получим, что
? Применим уравнение (17) к изобарному (Р = const) процессу. Тогда получим, что 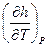 =
= 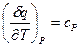 ; для идеального газа второй член в правой части формулы (18) отсутствует, и удельная теплоемкость сР характеризует темп роста энтальпии с температурой. Для идеального газа уравнение (17) может быть переписано в виде:
; для идеального газа второй член в правой части формулы (18) отсутствует, и удельная теплоемкость сР характеризует темп роста энтальпии с температурой. Для идеального газа уравнение (17) может быть переписано в виде:
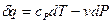 .
.
(19)
