Атомные спектры. Сериальные формулы. Опыты по рассеянию альфа-частиц (опыты Резерфорда)
Атомные спектры, спектры оптические, получающиеся при испускании или поглощении света (электромагнитных волн) свободными или слабо связанными атомами; такими спектрами обладают, в частности, одноатомные газы и пары. А. с. являются линейчатыми — они состоят из отдельных спектральных линий. А. с. наблюдаются в виде ярких цветных линий при свечении газов или паров в электрической дуге или разряде (спектры испускания) и в виде тёмных линий (спектров поглощения). Каждая спектральная линия характеризуется определённой частотой колебаний v испускаемого или поглощаемого света и соответствует определённому квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению: hv = Ei - Ek, где h — Планка постоянная). Наряду с частотой спектральную линию можно характеризовать длиной волны l = c/v, волновым числом 1/l = v/c (c — скорость света) и энергией фотона hv.
А. с. возникают при переходах между уровнями энергии внешних электронов атома и наблюдаются в видимой, ультрафиолетовой и близкой инфракрасной областях. Такими спектрами обладают как нейтральные, так и ионизованные атомы; их часто называют соответственно дуговыми и искровыми спектрами (нейтральные атомы легко возбуждаются и дают спектры испускания в электрических дугах, а положительные ионы возбуждаются труднее и дают спектры испускания преимущественно в искровых электрических разрядах). Спектры ионизованных атомов смещены по отношению к спектрам нейтральных атомов в область больших частот, т. е. в ультрафиолетовую область. Это смещение тем больше, чем выше кратность ионизации атома — чем больше электронов он потерял. Спектры нейтрального атома и его последовательных ионов обозначают в спектроскопии цифрами I, II, III, ... В реально наблюдаемых спектрах часто присутствуют одновременно линии нейтрального и ионизованных атомов; так говорят, например, о линиях FeI, FeII, FeIII в спектре железа, соответствующих Fe, Fe+, Fe2+.
Линии А. с. образуют закономерные группы, называются спектральными сериями. Промежутки между линиями в серии убывают в сторону коротких длин волн, и линии сходятся к границе серии. Наиболее прост спектр атома водорода. Волновые числа линий его спектра с огромной точностью определяются формулой Бальмера:
1/l = R(1/n21 - 1/n22), где n1 и n2 значения главного квантового числа для уровней энергии, между которыми происходит квантовый переход
Резерфорд предложил применить зондирование атома с помощью ?-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса ?-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал ?-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света). ?-частицы – это полностью ионизированные атомы гелия. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию ?-частицы. Рассеяние, то есть изменение направления движения ?-частиц, может вызвать только тяжелая положительно заряженная часть атома.
От радиоактивного источника, заключенного в свинцовый контейнер, ?-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Вспышки на экране наблюдались глазом с помощью микроскопа. Было обнаружено, что большинство ?-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие ?-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Он находился в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить ?-частицы назад. Резерфорд сделал вывод, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома. Вскоре опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Постулаты Бора.
Постулаты Бора:
Существуют стационарные состояния атома, находясь в которых он не излучает энергию. Для таких состояний электрон в атоме, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию : 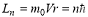 где m0 – масса электрона, V – скорость его движения на орбите радиуса r,
где m0 – масса электрона, V – скорость его движения на орбите радиуса r, 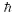 - постоянная Планка.
- постоянная Планка.
При переходе атома из стационарного состояния с номером n в стационарное состояние с номером m испускается или поглощается один фотон с энергией : 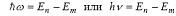
где Еn и Еm – энергия электрона на соответствующих орбитах.
