Фазовые превращения
Фазой называется термодинамически равновесное состояние вещества, отличаются не химическим составом, а физическим свойствами от других равновесных состояний того же вещества (например, вода может находиться в трех фазах: жидком, твердом и в виде пара). Переход вещества из одной фазы в другую называется фазовым переходом.
Различают фазовые переходы I и II рода. Фазовый переход I рода связан с поглощением или выделением тепла (например, плавление и кристаллизация). Фазовый переход II рода не связаны с теплотой (например, переход некоторых веществ при определенных температурах в сверхпроводящее состояние.
Для характеристики фазовых переходов используются диаграммы состояний (обычно в координатах Р – Т). На этих диаграммах можно найти точку одновременного равновесного осуществления трех фаз – тройную точку. Например, тройная точка для воды 273,12 К. Термодинамика позволяет рассчитать равновесие двух фаз одного вещества, пользуясь уравнением Клапейрона – Клаузиуса:
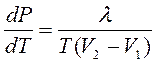 ,
,
где производная от равновесного давления по температуре зависит от теплоты фазового перехода λ, температуры перехода и изменения объема фаз (например, при замерзании воды ее объем возрастает).
2.12. Реальные газы. Уравнение Ван – дер – Ваальса
Уравнение Менделеева – Клапейрона для одного моля идеального газа имеет вид: PV= RT. Молекулы реального газа имеют размеры ~10-10 м и поэтому следует учитывать их собственный объем, т.е. в уравнение Менделеева – Клапейрона вводится поправка «b» на объем, занимаемый самими молекулами (V0 – b).
Действие сил взаимодействия между молекулами реального газа приводит к дополнительному внутреннему давлению Pi = a/V02, где V0 – объем 1 моля газа, т.е.
(Р + Pi) = (Р + a/V02)
Поправка «а» и «b» постоянны для данного газа. С учетом этого для 1 моля реального газа уравнение состояния – уравнение Ван – дер – Ваальса примет вид
(Р + a/V02) (V0 - b) = RT (2.54)
Это уравнение из-за сделанных упрощений приближенно описывает состояние реального газа.
На рис. 2.13 проведены изотермы Ван – дер – Ваальса для пропана при различных температурах. Если сравнивать их с изотермой идеального газа (рис.2.7), то заметим, что только при высоких температурах они схожи.
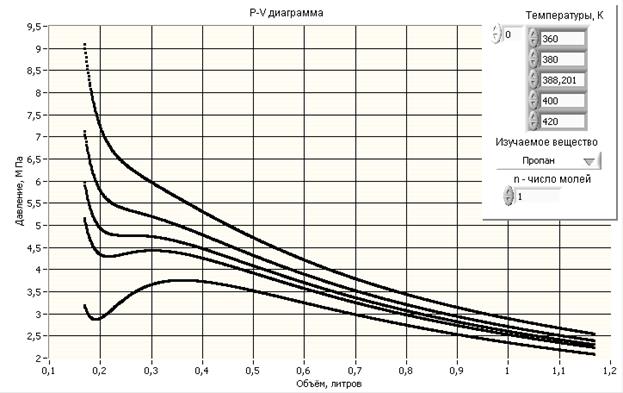
Рис.2.13
При низких температурах изотермы отличаются горбами, при этом одному давлению соответствует три объема. Среди изотерм Ван-дер-Ваальса есть такая, которая разграничивает изотермы с “горбами” от изотерм без “горбов” (Т=388,201К на Рис.2.13). Она отделяет области двухфазного состояния вещества (газообразного и жидкого) и однофазного (газообразного). Эта изотерма называется критическойи соответствующие ей параметры Р, V и Т также называются критическими. Понятие критической температуры Тк было введено Менделеевым. Менделеев рассматривал ее как температуру, при которой исчезают силы взаимодействия между молекулами и жидкость превращается в пар независимо от давления и занимаемого объема (на изотерме ей соответствует критическая точка).
