Два способи зміни внутрішньої енергії. Теплопередача (теплообмін)
Основні поняття термодинаміки.
Термодинаміка– теорія теплових явищ, у якій не враховується атомно-молекулярна будова тіл, процеси і явища розглядаються з точки зору перетворення енергії (у тому числі внутрішньої енергії тіл).
Термодинамічна система - це сукупність тіл, здатних обмінюватися енергією між собою і з іншими системами. Замкнута термодинамічна система не обмінюється енергією з іншими системами.
Термодинамічна рівновага - це стан, при якому параметри системи мають певні значення, що не змінюються з часом.
Основою термодинаміки є два її закони, що стосуються зміни енергії. Ці закони встановлені дослідним шляхом. Вони справедливі для всіх речовин незалежно від їх внутрішньої будови.
Внутрішня енергія.
В основі термодинаміки лежить поняття внутрішньої енергії.
Приклад. Падіння кулі на свинцеву пластину (велика прочніть - майже без деформації).
Механічна енергія (потенціальна в кінетичну і частково внутрішню через тертя) перейшла у внутрішню (нагрівання пластини), тобто теплову енергію. Це є ЗЗЕ.
Приклад. Вибивання пробки газом.
Будь-яке макроскопічне тіло має певний запас внутрішньої енергії U. Вона складається з кінетичної енергії безладного руху (поступального і, якщо є, обертального), і потенціальної енергії взаємодії молекул цього тіла (енергії хімічних реакцій в тілі).

Не враховуємо обертальний, коливальний рухи молекул і хімічні процеси в тілі, маємо:  (Слід розуміти, що у внутрішню енергію не включаються кінетична і потенційна енергія самого тіла.)
(Слід розуміти, що у внутрішню енергію не включаються кінетична і потенційна енергія самого тіла.)
Два способи зміни внутрішньої енергії. Теплопередача (теплообмін).
Два способи: виконання роботи і теплообмін (теплопередача) з іншими тілами.


Q – кількість теплоти [Дж] – енергія, яку тіло отримало/віддало внаслідок теплопередачі (теплообміну).
Три види теплообміну: теплопровідність, конвекція, променевий теплообмін (випромінювання).
5. Розрахунок кількості теплоти при теплових процесах.

Нагрівання - охолодження:  , m – маса тіла; t – температура; с – питома теплоємність тіла [c=
, m – маса тіла; t – температура; с – питома теплоємність тіла [c= 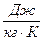 ], табл. значення, оказує яку кількість теплоти в Дж тіло масою 1 кг отримує (віддає) при нагріванні (охолодженні) на 1К.
], табл. значення, оказує яку кількість теплоти в Дж тіло масою 1 кг отримує (віддає) при нагріванні (охолодженні) на 1К.
Оскільки вода відіграє величезну роль у житті людини, за її питомою теплоємністю була введена спеціальна одиниця виміру кількості теплоти - калорія це кількість теплоти, необхідне для нагрівання 1 грама води на 1°C. 1 кал 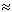 4,2 Дж
4,2 Дж
Плавлення – кристалізація (для кристалічних тіл) або тверднення (для аморфних): 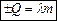 ,
,  - питома теплота плавлення тіла [
- питома теплота плавлення тіла [  ], табл. значення, показує яку кількість теплоти в Дж тіло масою 1 кг отримує (віддає) при плавленні (кристалізації, твердненні).
], табл. значення, показує яку кількість теплоти в Дж тіло масою 1 кг отримує (віддає) при плавленні (кристалізації, твердненні).
Пароутворення – конденсація:  .
.
Теплота згорання палива (кількість теплоти, що виділяється при згоранні палива): 
Графік
Рівняння теплового балансу: якщо тіла утворюють замкнуту систему і між ними відбувається тільки теплообмін, то алгебраїчна сума отриманих Q відданих Q енергій дорівнює нулю О (отримана Q береться зі знаком плюс, а віддана Q теплоти - зі знаком мінус).
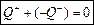
6. Внутрішня енергія одноатомного газу.
Порахувати внутрішню енергію як  використовуючи МКТ досить важко. Найпростіший випадок: молекули таких одноатомних газів як гелій, неон, аргон здійснюють лише поступальний рух (без обертального), тому такі гази можна вважати майже ідеальними. Внутрішня енергія ідеального газу:
використовуючи МКТ досить важко. Найпростіший випадок: молекули таких одноатомних газів як гелій, неон, аргон здійснюють лише поступальний рух (без обертального), тому такі гази можна вважати майже ідеальними. Внутрішня енергія ідеального газу:













Висновок: Внутрішня енергія одноатомного ідеального газу залежить прямо пропорційно від маси тіла і температури, і є обернено пропорційною до роду речовини.
У реальних газів, рідин і твердих тіл 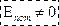 , U залежить від займає мого V (оскільки V пов’язаний з відстанню між частинка тіла (молекулами тощо), і з величиною їх взаємодії).
, U залежить від займає мого V (оскільки V пов’язаний з відстанню між частинка тіла (молекулами тощо), і з величиною їх взаємодії).
7. Робота в термодинаміки. Робота газу. 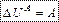
Газ на відміну від рідин і твердих тіл при нагріванні не тільки збільшує внутрішню енергію за рахунок кінетичної енергії, але й розширюючись при нагріванні, виконує роботу, яка залежить від виду теплового процесу.
Приклад. При накачуванні повітря в велосипедну шину він нагрівається. Молекули газу отримують енергію від поршня (аналогія: нога футболіста і м'яч)
Нехай у циліндрі з рухомим поршнем знаходиться газ. При нагріванні газ розширюється, і поршень переміщається на відстань 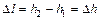 . При розширенні газу, молекули при зіткненні з поршнем, що віддаляється, зменшують свою швидкість і внутрішню енергію.
. При розширенні газу, молекули при зіткненні з поршнем, що віддаляється, зменшують свою швидкість і внутрішню енергію.
 Якщо
Якщо  невелика, то тиск газу залишиться приблизно постійним
невелика, то тиск газу залишиться приблизно постійним 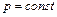 (ізобарне розширення). Тоді робота газу
(ізобарне розширення). Тоді робота газу  буде дорівнювати:
буде дорівнювати:
 (
(  )
) 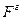 - сила, з якою газ діє на поршень.
- сила, з якою газ діє на поршень.
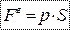
 - робота газу (виконує газ).
- робота газу (виконує газ).
 - робота, що виконується над газом (за ІІІ з. Н.
- робота, що виконується над газом (за ІІІ з. Н.  ).
). 
При стисканні газу: робота газу 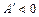 (оскільки
(оскільки  ); робота сторонніх сил А>0. При розширенні навпаки. При стисненні зовнішні сили передають енергію, при розширенні газ здійснює роботу, його енергія зменшується.
); робота сторонніх сил А>0. При розширенні навпаки. При стисненні зовнішні сили передають енергію, при розширенні газ здійснює роботу, його енергія зменшується.
8. Графічний (геометричний) зміст роботи.

 Сторони заштрихованого під графіком прямокутника рівні p і ∆V, тому робота газу при ізобарному процесі дорівнює площі цього прямокутника.
Сторони заштрихованого під графіком прямокутника рівні p і ∆V, тому робота газу при ізобарному процесі дорівнює площі цього прямокутника.
Узагальнюючи отриманий результат на будь-який процес, наприклад, ізотермічний, можна зробити висновок:
Робота газу при довільному процесі дорівнює площі криволінійної трапеції під графіком зображує цей процес в координатах p,V.
