Определение в структурах координационных
ЧИСЕЛ, КООРДИНАЦИОННЫХ МНОГОГРАННИКОВ
И ПЛОТНОСТИ УПАКОВОК
Координационным числом (к.ч.) данного атома или иона называется число ближайших однотипных соседних атомов или ионов в кристаллической структуре. Если центры ближайших атомов соединить прямыми линиями, получается координационный многогранник. Атом, для которого строится координационный многогранник, находится в его центре.
Ионные структуры являются устойчивыми, если каждый ион окружен ионами. На основе геометрической схемы можно рассчитать границы стойкости структур. Такой расчет дает следующие границы стойкости (А - катион, Х –анион):
Координационное число Координационный многогранник
0...0,15 2 Гантель
0,15... 0,22 3 Треугольник
0,22... 0,41 4 Тетраэдр
0,41... 0,73 6 Октаэдр
0,73... 1,00 8 Куб
1,00 12 Кубооктаэдр
Для ковалентных структур координационное число определяется из формулы (8 – N), N- номер группы периодической системы, где находиться элемент. Так, например, сера находиться в 6 группе, ее координационное число будет 8-6=2, если отношение ra/rx находится вблизи пограничного, ион может иметь два координационных числа. Координационное число зависит не только от геометрических размеров, но и от поляризуемости атомов, от характеров сил связи.
Для устойчивости кристаллических решеток необходим минимум потенциальной энергии. Одним из факторов, уменьшающим потенциальную энергию, является максимальное сближение структурных единиц, их плотная упаковка. Тенденция к плотной упаковке является характерной для всех кристаллических структур, но сильнее всего она выражена в ионных и металлических структурах.
Если условно представить себе, что атомы являются сферическими шарами, то в плоскости шары укладываются плотно следующим образом: каждый шар окружен 6-ю шарами и 6-ю лунками, а каждая лунка тремя шарами. Второй слой шаров укладывается, закрывая половину лунок. Между двумя слоями шаров образуется два типа пустого пространства, которые отличаются по координационному окружению.
Пустоты первого типа образуются тремя шарами и находятся над вторым слоем шаров. Такая пустота называется тетраэдрической, потому что центры четырех шаров образуют правильный тетраэдр (рис. 28 а).
Пустоты второго слоя находятся над пустотами первого слоя: пустота окружена 6-ю шарами располагающимися по вершинам октаэдра. Соответственно, пустоту называют октаэдрической (рис. 28 б).
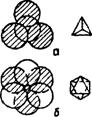
Рис. 28 – Пустоты плотной упаковки: а – тетраэдрическая,
б – октаэдрическая
Третий слой упаковки можно представить двумя способами. Первый способ - это расположение шаров таким образом, чтобы центры шаров первого слоя находились над центрами второго слоя. При этом образуется упаковка типа АВАВ. Она называется гексагональной плотной упаковкой (ГПУ) (рис. 29а). Такая упаковка имеет ось симметрии третьего порядка. ГПУ характерна для Мg, Ве, Zn и некоторых других металлов. Если поместить шары третьего слоя в другие лунки, то не третий слой повторит первый, а лишь четвертый. Выходят упаковки типа АВС. Такая упаковка имеет четыре оси симметрии L3. Она называется кубической и отвечает гранецентрованной кубической решетке (ГЦК) (рис. 29б). По этому типу кристаллизуются такие металлы, как Сu, Аu, Аg , Рt, Са, Sr, Рb и др.
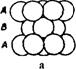
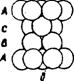
Рис. 29 – Плотные упаковки: а - двухслойная гексагональнальная типа АВАВ, б – трехслойная кубическая типа АВС
Порядок выполнения работы:
1. Внимательно изучить полученные кристаллические решетки
2. Определить к.ч. для всех атомов, которые входят в заданную структуру;
3. Определить тип координационных многогранников
4. Вычислить к.ч. атомов с учетом ионных радиусов и границ устойчивости.
5. Определить тип упаковки
6. Найти тетраэдрические и октаэдрические пустоты в упаковке.
МИНЕРАЛОГИЯ
Практическая работа №7
ВЫРАЩИВАНИЕ КРИСТАЛЛОВ
Из существующих методов выращивания кристаллов наиболее распространенными являются кристаллизация из пересыщеных растворов и расплавов солей.
Образование кристаллов из жидкой фазы (раствора или расплава) зависит от механизма и условий протекания процесса кристаллизации. Обычно различают два механизма: гомогенный, когда новая фаза зарождена в объеме старой, и гетерогенный, когда этот процесс наблюдается на границе фаз.
Начальной стадии кристаллизации является образование критического зародыша. Зародыши, радиус которых меньше 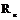 , метастабильны и растворяются (расплавляются) вновь, потому что их увеличение связанно с повышением свободной энергии. Зародыши, имеющие размер выше критического, напротив, устойчивы и способны расти, т.к. величина
, метастабильны и растворяются (расплавляются) вновь, потому что их увеличение связанно с повышением свободной энергии. Зародыши, имеющие размер выше критического, напротив, устойчивы и способны расти, т.к. величина 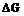 понижается. Такие зародыши называются центрами кристаллизации.
понижается. Такие зародыши называются центрами кристаллизации.
Размер критического зародыша будет равен 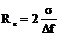 , где
, где
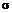 - коэффициент поверхностного натяжения между твердой и жидкой фазами;
- коэффициент поверхностного натяжения между твердой и жидкой фазами;
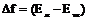 , где
, где 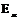 и
и 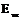 - свободная энергия единицы объема жидкой и твердой фаз.
- свободная энергия единицы объема жидкой и твердой фаз.
Дальнейший рост зародыша происходит в результате перехода атомов из переохлажденной жидкости (расплава) к кристаллам.
Кристалл растет послойно, при этом каждый слой имеет одноатомную толщину.
Различают два элементарных процесса роста кристаллов.
1. Флуктуационное образование двумерного зародыша одноатомной толщины на плоских гранях кристалла. Двумерный зародыш должен иметь размер не меньше критического. При меньшем размере зародыш не будет устойчив, т.к. вследствие образование дополнительной поверхности раздела свободная энергия системы возрастает.
2. Рост двумерного зародыша за счет атомов, поступающих из переохлажденной жидкости (расплава). После образования на плоской грани двумерного зародыша дальнейший рост нового слоя протекает сравнительно легко, т.к. появляются участки, удобные для закрепления атомов, переходящих из жидкости. Скорость роста кристаллов определяется вероятностью образования двумерного зародыша. Чем больше степень переохлаждения, тем меньше величина зародыша, и тем легче он образуется.
Процесс выращивания кристаллов из пересыщенных растворов заключается в приготовлении последнего. Существует различные методы создания пересыщенного состояния растворов: испарение растворителя, высаливание растворенного вещества, химического взаимодействия веществ, термический метод.
Термический метод является наиболее распространенным и используется для веществ с большим положительным и отрицательным температурным коэффициентам растворимости. При непрерывном нагреве (или охлаждении) насыщенного раствора пересыщение монотонно возрастает. Скорость зарождения центров кристаллизации является функцией времени, пересыщения, температуры раствора и скорости его охлаждения 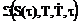 .
.
Среди способов кристаллизации из расплава особое место занимают те, в которых боковая поверхность кристалла формируется без контакта со стенками тигля – это способы Чохральского, Степанова, Вернейля. Во всех способах форма и размер получающегося кристалла определяются капиллярными силами, формирующими мениск в зоне межфазной границы и условиями тепло – и массообмена в системе кристалл-расплав.
Выращивание кристаллов способом Чохральского осуществляется со свободной поверхности расплава на затравку, поднимаемую вертикально вверх. Способ Степанова от способа Чохральского отличается наличием формообразующего устройства на поверхности расплава. По методу Вернейля тонко измельченный порошок материала, из которого выращивается кристалл, подается в пламя горелки. Порошок полностью или частично плавится, создавая на поверхности затравочного кристалла расплавленный слой. Рост кристалла происходит при последовательной кристаллизации расплава в результате опускания кристалла в более холодную зону.
Порядок выполнения работы.
I. Кристаллизация из пересыщенных растворов.
1. Взвесить исходное вещество ( 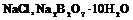 ), в количестве, превышающем его растворимость при данной температуре и растворить в 100г горячей воды.
), в количестве, превышающем его растворимость при данной температуре и растворить в 100г горячей воды.
2. Нагреть раствор на песчаной бане до полного растворения соли и отфильтровать.
3. Подвесить затравку (кристаллик на кончике шелковой нити) и опустить ее в стакан с пересыщенным раствором.
4. Аккуратно поставить содержимое стакана в эксикатор с заполненным на дне 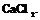
5. Внимательно изучить структуру выращенного кристалла под микроскопом, зарисовать его и указать сингонию.
II. Кристаллизация из расплавов.
1. Взять небольшое количество вещества с низкой температурой плавления ( 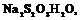
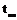 -132,7
-132,7 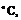 тимол,
тимол, 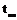 -51,5
-51,5 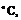 салол,
салол, 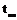 -42
-42 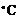 ).
).
2. Поместить исходное вещество на предметное вещество и медленным нагреванием расплавить его.
3. Полученный расплав закрыть стеклянной крышкой так, чтобы часть расплава выступала из под нее.
4. Охладить расплав до комнатной температуры и внести затравку в выступающую часть (кристаллик на кончике иглы).
5. Изучить под микроскопом характер образовавшихся кристаллов и зарисовать их.
Приложение №1
Простые формы и их комбинации в геометрической кристаллографии.
| Сингония | Виды Симметрии | Названия простых форм, возможных в данном виде симметрии | Примеры комбинаций |
| Триклинная | 1. Примитивный (моноэдрический) | Моноэдры | Кислый правый виннокислый стронций - 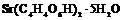  |
| 2. Центральный (пинакоидальный) | Пинакоиды | Аксинит - 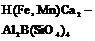  | |
| Моноклинная | 3. Планальный (диэдрический безосный) | Моноэдры Пинакоид Диэдры | Паратолуидо-изомаслянокислый эфир - 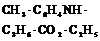 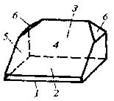 |
| 4. Аксиальный (диэдрический осевой) | Моноэдры Пинакоиды Диэдры | Молочный сахар - 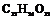 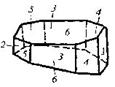 | |
| 5. Планаксиальный (призматический) | Пинакоиды Ромбические Призмы | Реальгар - 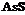 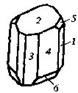 | |
| Ромбическая | 6. Планальный (ромбо-пирами-дальный) | Моноэдры Пинакоиды Диэдры Ромбические призмы Ромбические пирамиды | Струвит - 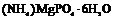 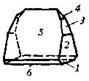 |
| 7. Аксиальный (ромбо-тетра-эдрический) | Пинакоиды Ромбические призмы Ромбические тетраэдры | Эпсомит - 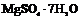 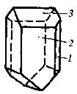 | |
| 8. Планаксиальный (ромбо-дипирамидальний) | Пинакоиды Ромбические призмы Ромбические дипирамиды | Оливин - 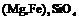 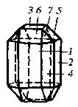 | |
| Тригональная | 9. Примитивный (тригонально-пирамидальный) | Моноэдры Тригональные призмы Тригональные пирамиды | Метапериодат натрия – гексагидрат   |
| 10. Центральный (ромбоэдрический) | Пинакоид Гексагональные призмы Ромбоэдры | Диоптаз -   | |
| 11. Планальный (дитригонально-пирами- пальный) | Моноэдры Тригональные призмы Дитригональные призмы Гексагональная призма Тригональные пирамиды Гексагональные пирамиды Дитригональные пирамиды | Турмалин – сложный алюмосиликат, содержащий бор 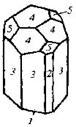 | |
| 12. Аксиальный (тригонально-трапецо-эдрический) | Пинакоид Тригональные призмы Дитригональные призмы Гексагональная призма Тригональные дипирамиды Ромбоэдры Тригональиые Трапецоэдры | Низкотемпературный кварц - 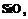 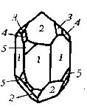 | |
| 13. Планаксиальный (тригонально-скалено-эдрический) | Пинакоид Гексагональные призмы Дигексагональны Гексагональные дипирамиды Ромбоэдры Тригональные Скаленоэдры | Кальцит - 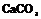  | |
| Тетрагональная | 14. Примитивный (тетрагонально-пирамидальный) | Моноэдры Тетрагональные призмы Тетрагональные пирамиды | Фергусонит -   |
| 15. Центральный (тетрагонально-дипирамидальный) | Пинакоид Теграгоиальные призмы Тетрагональные дипирамиды | Повеллит -  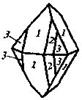 | |
| 16. Планальный (дитетрагонально-пирамидальный) | Моноэдры Тетрагональные призмы Дитетрагональные призмы Тетрагональные пирамиды Дитетрагональные пирамиды | Моногидрат фтористого серебра -  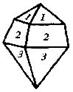 | |
| 17. Аксиальный (тетрагонально-трапецоэдрический) | Пинакоид Тетрагональные призмы Дитетрагональные призмы Тетрагональные дипирамиды Тетрагональные трапецоэдры | Дитрихлордиацетат калия -  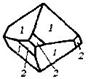 | |
| 18. Планаксиальный (дитетрагонально-дипирамидальный) | Пинакоид Тетрагональные призмы Дитетрагональные призмы Тетрагональные дипирамиды Дитетрагональные дипирамиды | Циркон -  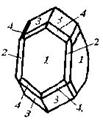 | |
| 19.Инверсионно-примитивный (тетрагонально-тетраэдрический) | Пинакоид Тетрагональные призмы Тетрагональные тетраэды | Иодид тетраэтил-аммония -  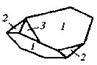 | |
| 20. Инверсионно-планальный (тетрагонально-скалено-эдрический) | Пинакоид Тетрагональные призмы Дитетрагональные призмы Тетрагональные тетраэды Тетрагональные скаленоэдры | Карбамид - 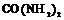 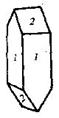 | |
| Гексагональная | 21. Примитивный (гексагонально-пирамидальный) | Моноэдры Гексагональные призмы Гексагональные пирамиды | Сульфат лития и калия - 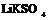 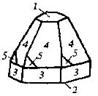 |
| 22. Центральный (гексагонально-дипирамидальный) | Пиканоид Гексагональные призмы Гексагональные дипирамиды | Апатит -   | |
| 23. Планальный (дигексагонально-пирамидальный) | Моноэдры Гексагональные призмы Дигексагональные призмы Гексагональные пирамиды Дигексагональные пирамиды | Гринокит -   | |
| 24. Аксиальный (гексагонально-трапецоэдрический) | Пинакоид Гексагональные призмы Дигексагональные призмы Гексагональные дипирамиды Гексагональные трапецоэдры | Высокотемпературный кварц - 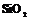 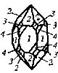 | |
| 25. Планаксиальный (дигексагонально-дипирамидальный) | Пинакоид Гексагональные призмы Дигексагональные призмы Гексагональные дипирамиды Дигексагональные дипирамиды | Берилл - 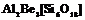 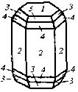 | |
| 26. Инверсионно-примитивный (тригонально-дипирамидальный) | Пинакоид Тригональные призмы Тригональные дипирамиды | Кислый фосфат серебра (?) - 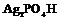 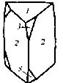 | |
| 27. Инверсионно-планальный (дитригонально-дипирамидальный) | Пинакоид Тригональные призмы Дитригональные призмы Гексагональная призма Тригональные дипирамиды Гексагональные дипирамиды Дитригональные дипирамиды | Ферросилиций - 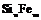 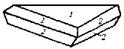 | |
| Кубическая | 28. Примитивный (пентагон-тритетра-эдрический) | Гексаэдр (куб) Ромбо-додекаэдр Пентагон-додекаэдры Тетраэдры Тригон-тритетраэдры Тетрагон-тритет-раэдры Пентагон-тритетраэдры | Хлорноватокислый натрий - 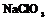 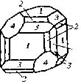 |
| 29. Центральный (гидодека-эдрический) | Гексаэдр (куб) Ромбо-додекаэдр Пентагон-додекаэдры Октаэдр Тетрагон-триокта-эдры Тригон-триокта-эдры Дидодекаэдры | Пирит - 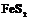 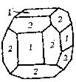 | |
| 30. Планальный (гексатетра-эдрический) | Гексаэдр (куб) Ромбо-додекаэдр Тетрагексаэдры Тетраэдры Тригон-тритетра-эдры Тетрагон-тритетраэдры Гексатетраэдры | Блеклая руда -   | |
| 31. Аксиальный (пентагон-триокта-эдрический) | Гексаэдр (куб) Ромбо-додекаэдр Тетрагексаэдры Октаэдр Тетрагон-триокта-эдры Тригон-триокта-здры Пентагон-триоктаэдры | Хлористый аммоний -   |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Шаскольская М.П. Кристаллография.– М.: Высш.шк., 1976. – 391 с.
2. Бондарев В.П. Основы минералогии и кристаллографии. – М.: Высш.шк., 1985. – 287 с.
3. Миловский А.В. Минералогия и петрография.– М.:Недра, 1978. – 439с.
4. Торопов Н.А., Гулак Д.Н. Кристаллография и минералогия. – Л.: Стройиздат, 1972. –502с.
5. Шафрановский И.И., Алявдин В.Ф. Краткий курс кристаллографии. –М.:Высш.шк., 1984. –120с.
Учебное издание
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к практическим занятиям по дисциплине
«КРИСТАЛЛОГРАФИЯ, КРИСТАЛЛОХИМИЯ И МИНЕРАЛОГИЯ» (для студентов, обучающихся по направлению
«Инженерная механика»)
Составитель
ЖДАНОВА Майя Николаевна
