Политропный процесс, его частные случаи: изобарный, изотермический, адиабатный, изохорный.
Процесс, в ко тором теплоемкость остается постоянной, называется политропным.
Исходя из первого начала термодина мики при условии постоянства теплоемко сти (C = const) можно вывести уравнение политропы:
pVn = const, (55.9) где n=(C-Ср)/(С-Cv) — показатель политропы. Очевидно, что при С = 0, n= из (55.9) получается уравнение адиабаты; при С=, n=1 —уравнение изотермы; при С=СР, n = 0 — уравнение изобары, при С = Сv, n=± —уравнение изохоры.
Среди равновесных процессов, происходя щих с термодинамическими системами, выделяются изопроцессы,при которых один из основных параметров состояния сохраняется постоянным.
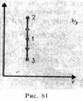
Изохорный процесс(V = const). Диаг рамма этого процесса (изохора)в коорди натах р, V изображается прямой, парал лельной оси ординат (рис. 81), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
A=pdV = 0.
Как уже указывалось в § 53, из первого начала термодинамики (Q=dU+A) для изохорного процесса следует, что вся теп лота, сообщаемая газу, идет на увеличе ние его внутренней энергии:
Q =dU
Согласно формуле (53.4), dUm = CvdT.
Тогда для произвольной массы газа по лучим
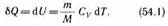
Изобарный процесс(р=const). Диаграмма этого процесса (изобара)в координатах р, V изображается прямой, парал лельной оси V

. При изобарном процессе работа газа при расширении объема от V1до V2 равна
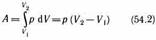
и определяется площадью прямоугольни ка, выполненного в цвете на рис. 82. Если использовать уравнение Клапейро на — Менделеева для выбранных нами двух состояний, то
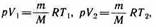
откуда
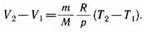
Тогда выражение (54.2) для работы изо барного расширения примет вид
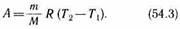
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2-T1=1К, то для 1 моля газа R=А, т. е. R численно равна работе изо барного расширения 1 моля идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой от количества теплоты
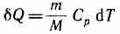
его внутренняя энергия возрастает на ве личину (согласно формуле (53.4))
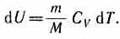
При этом газ совершит работу, определяе мую выражением (54.3).
Изотермический процесс(T=const). Изотермиче ский процесс описывается законом Бой ля — Мариотта:
pV=const.
Диаграмма этого процесса (изотерма)в координатах р, V представляет собой гиперболу, расположенную на диаграмме тем выше, чем выше темпе ратура, при которой происходил процесс. Найдем работу изотермического расшире ния газа:
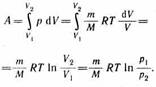
Так как при T=const внутренняя энергия идеального газа не изменяется:
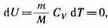
то из первого начала термодинамики (Q =dU+A) следует, что для изотермиче ского процесса
Q=A,
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им рабо ты против внешних сил:
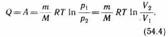
Следовательно, для того чтобы при рабо те расширения температура не уменьша лась, к газу в течение изотермического процесса необходимо подводить количест во теплоты, эквивалентное внешней работе расширения.
