Законравномерногораспределенияэнергиипостепенямсвободымолекул
Термодинамическое равновесное состояние тела это такое состояние, когда внутренняя энергия распределена равномерно по всем внутренним степеням свободы тела.
В простейшем случае у тела 3*N внутренних степеней свободы, где N - общее число молекул в данном теле.
Или
Молекулы можно рассматривать как системы материальных точек (атомов) совершающих как поступательное, так и вращательное движения. При исследовании движения тела необходимо знать его положение относительно выбранной системы координат. Для этого вводится понятие о степенях свободы тела. Число независимых координат, которые полностью определяют положение тела в пространстве, называется числом степеней свободы тела.
При движении точки по прямой линии для оценки ее положения необходимо знать одну координату, т.е. точка имеет одну степень свободы. Если точка движения по плоскости, ее положение характеризуется двумя координатами; при этом точка обладает двумя степенями свободы. Положение точки в пространстве определяется 3 координатами. Число степеней свободы обычно обозначают буквой i. Молекулы, которые состоят из обычного атома, считаются материальными точками и имеют три степени свободы (аргон, гелий).
28)Работа газа при изменении его объема
Работа совершается только тогда, когда изменяется объем.
Найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде. Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
dA=Fdl=pSdl=pdV, где S-площадь поршня, Sdl=dV-изменение объема системы. Таким образом, dA= pdV.(1)
Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы (1): A= òpdV(от V1 до V2).(2)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
| Полная работа газа будет равна площади фигуры, ограниченной осью абсцисс, кривой и значениями V1,V2. |
| V |
| Р |
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах p,V.
Графически можно изображать только равновесные процессы — процессы, состоящие из последовательности равновесных состояний. Они протекают так , что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев их неравновесностью можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному).
29)Внутренняя энергия
Вну́тренняяэне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
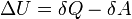
где
· 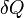 — подведённое к телу количество теплоты, измеренное в джоулях
— подведённое к телу количество теплоты, измеренное в джоулях
· 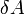 [1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
[1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Для квазистатических процессов выполняется следующее соотношение:
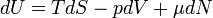
где
· 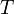 — температура, измеренная в кельвинах
— температура, измеренная в кельвинах
· 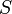 — энтропия, измеренная в джоулях/кельвин
— энтропия, измеренная в джоулях/кельвин
· 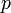 — давление, измеренное в паскалях
— давление, измеренное в паскалях
· 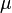 — химический потенциал
— химический потенциал
· 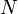 — количество частиц в системе
— количество частиц в системе
30)Количество теплоты
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основныхтермодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Единица измерения в Международной системе единиц (СИ): Джоуль.
Определение
Рассмотрим систему, состоящую из двух тел 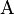 и
и 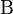 . Предположим, что тело
. Предположим, что тело 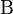 заключено почти полностью в жёсткую адиабатическую оболочку, так что оно не способно совершать макроскопическую работу, а обмениваться теплом (то есть энергией) посредством микроскопических процессов может лишь с телом
заключено почти полностью в жёсткую адиабатическую оболочку, так что оно не способно совершать макроскопическую работу, а обмениваться теплом (то есть энергией) посредством микроскопических процессов может лишь с телом 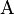 . Предположим, что тело
. Предположим, что тело 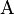 также заключено в адиабатическую оболочку почти полностью, так что для него возможен теплообмен лишь с
также заключено в адиабатическую оболочку почти полностью, так что для него возможен теплообмен лишь с 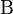 , но не будем предполагать, что оболочка жёсткая. Количеством теплоты, сообщённой телу
, но не будем предполагать, что оболочка жёсткая. Количеством теплоты, сообщённой телу 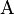 в некотором процессе, будем называть величину
в некотором процессе, будем называть величину 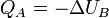 , где
, где 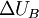 — изменение внутренней энергии тела
— изменение внутренней энергии тела 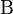 . Согласно закону сохранения энергии,
. Согласно закону сохранения энергии,
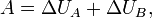
где 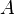 — макроскопическая работа внешних сил над телом
— макроскопическая работа внешних сил над телом 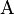 . Если учесть, что
. Если учесть, что
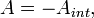
где 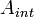 — работа, совершённая телом
— работа, совершённая телом 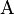 , то по закону сохранения энергии можно придать форму первого начала термодинамики:
, то по закону сохранения энергии можно придать форму первого начала термодинамики:
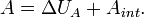
Из первого начала термодинамики следует корректность введённого определения количества теплоты, то есть независимость соответствующей величины от выбора пробного тела 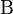 и способа теплообмена между телами. Заметим, что для определения количества теплоты необходимо пробное тело, в противном случае первое начало теряет смысл содержательного закона и превращается в определение количества теплоты (весьма бесполезное в таком виде). При определении количества теплоты независимо от
и способа теплообмена между телами. Заметим, что для определения количества теплоты необходимо пробное тело, в противном случае первое начало теряет смысл содержательного закона и превращается в определение количества теплоты (весьма бесполезное в таком виде). При определении количества теплоты независимо от 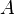 и
и 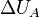 первое начало становится содержательным законом, допускающим экспериментальную проверку.
первое начало становится содержательным законом, допускающим экспериментальную проверку.
Отметим, что, как и совершённая работа, количество переданной теплоты зависит от конкретного процесса, совершённого над телом.
31)Первоеначалотермодинамики. Теплоемкость
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии длятермодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физикаДж. П. Джоуля и немецкого физика Г. Гельмгольца[1]. Согласно первому началу термодинамики, термодинамическая система может совершать работутолько за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
С формулами
Рассмотрим систему, которая получает энергию в процессе теплообмена. Пусть для изменения температуры системы на ΔT потребовалось количество теплоты Q. Теплоемкостью системы называется величина
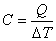 . . | (4.20) |
Если в качестве системы рассматривать 1 моль вещества, то теплоемкость, определяемая соотношением (4.20), называется молярной теплоемкостью. Удельная теплоемкость (теплоемкость единицы массы вещества) связана с молярной теплоемкостью очевидным равенством:
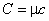 . . | (4.21) |
В уравнении (4.19) величина A, как было показано выше, является функцией процесса, тогда и величина Q, очевидно, зависит от условий процесса и является его функцией. ПосколькуQ есть функция процесса, то и теплоемкость, естественно, есть функция процесса и для ее определения необходимо указать условия процесса. Обычно различают теплоемкость при постоянном объеме СV (изохорный процесс) и теплоемкость при постоянном давлении СР (изобарный процесс). Воспользуемся уравнением (4.19) для определения величин СР и СV и установления соотношения между ними.
При изохорном процессе 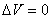 и, как следует из (4.16), работа равна нулю. При этом условии, используя (4.19) и (4.20), находим
и, как следует из (4.16), работа равна нулю. При этом условии, используя (4.19) и (4.20), находим
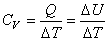 . . | (4.22) |
Для изобарного процесса, используя равенства (4.16), (4.19) и (4.22), получаем
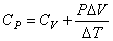 . . | (4.23) |
Уравнение (4.23) показывает, что теплоемкость СР больше СV на величину работы, совершаемой системой при ее изобарном нагревании на 1ºС.
Для моля идеального газа уравнение состояния имеет вид:
| PV = RT. |
Применение этого уравнения к двум состояниям моля газа в изобарном процессе приводит к соотношению
| РΔV = RΔT. | (4.24) |
Подставляя (4.24) в (4.23), получаем
| CP = CV + R. | (4.25) |
Полученное уравнение называется уравнением Роберта Майера. Из сравнения уравнений (4.23) и (4.25) легко вскрыть физический смысл универсальной газовой постоянной. Эта величина, очевидно, равна работе изобарического расширения моля идеального газа при его нагревании на один Кельвин.
Уравнение Майера
- ур-ние, устанавливающее связь между теплоёмкостями при пост, давлении Cp и пост, объёме С V 1 кмоля идеального газа: 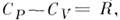 где R- газовая постоянная. Впервые было получено Ю. P. Майером (J. R. Mayer) в 1842 и ещё до работ Дж. П. Джоуля (J. P. Joule) использовано им для количеств, определения механического эквивалента теплоты. Для произвольной массы т (кг) вещества в состоянии идеального газа M. у. записывается в виде:
где R- газовая постоянная. Впервые было получено Ю. P. Майером (J. R. Mayer) в 1842 и ещё до работ Дж. П. Джоуля (J. P. Joule) использовано им для количеств, определения механического эквивалента теплоты. Для произвольной массы т (кг) вещества в состоянии идеального газа M. у. записывается в виде: 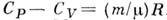 , где
, где 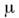 - молекулярная масса газа. M. у. можно получить из общего соотношения
- молекулярная масса газа. M. у. можно получить из общего соотношения 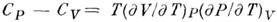 (см. Термодинамика), если учесть, что для идеального газа справедливо Клапейрона уравнение.
(см. Термодинамика), если учесть, что для идеального газа справедливо Клапейрона уравнение.
33)Применениепервогоначалатермодинамикикизопроцессам
Изохорический процесс (V = const). Работа в этом процессе, как следует из (4.16), равна нулю. Процесс сводится к теплообмену системы с окружающей средой. Первый закон термодинамики при этом условии принимает вид:
| Q = ΔU. | (4.18) |
2. Изобарический процесс (Р = const). На основании определения теплоемкости (4.20) количество теплоты Q, подведенное к системе в изобарном процессе, для одного моля идеального газа равно:
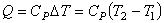 . Изотермический процесс. При изотермическом процессе температура системы не изменяется (ΔТ = 0), а, следовательно, ее внутренняя энергия, являясь для идеального газа только функцией температуры, остается постоянной, то есть ее изменение ΔU = 0. Это значит, что сообщаемое системе количество теплоты идет на совершение работы. . Изотермический процесс. При изотермическом процессе температура системы не изменяется (ΔТ = 0), а, следовательно, ее внутренняя энергия, являясь для идеального газа только функцией температуры, остается постоянной, то есть ее изменение ΔU = 0. Это значит, что сообщаемое системе количество теплоты идет на совершение работы.
Найдем работу расширения моля идеального газа в изотермическом процессе. Изотерма в координатах Р – V представляется гиперболой (рис. 4.9). Как уже было рассмотрено ранее, работу расширения газа от начального объема V1 до V2 можно найти, используя равенство (4.17):
|
Определения
Последовательность инструкций, предназначенная для многократного исполнения, называется телом цикла. Единичное выполнение тела цикла называется итерацией. Выражение определяющее, будет в очередной раз выполняться итерация, или цикл завершится, называется условием выхода или условием окончания цикла (либо условием продолжения в зависимости от того, как интерпретируется его истинность — как признак необходимости завершения или продолжения цикла). Переменная, хранящая текущий номер итерации, называется счётчиком итераций цикла или просто счётчиком цикла. Цикл не обязательно содержит счётчик, счётчик не обязан быть один — условие выхода из цикла может зависеть от нескольких изменяемых в цикле переменных, а может определяться внешними условиями (например, наступлением определённого времени), в последнем случае счётчик может вообще не понадобиться.
Исполнение любого цикла включает первоначальную инициализацию переменных цикла, проверку условия выхода, исполнение тела цикла и обновление переменной цикла на каждой итерации. Кроме того, большинство языков программирования предоставляют средства для досрочного управления циклом, например, операторы завершения цикла, то есть выхода из цикла независимо от истинности условия выхода (в языке Си — break) и операторы пропуска итерации (в языке Си — continue).
37)Энтропия
Энтропи́я (от др.-греч. ἐντροπία — поворот, превращение) — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Энтропия в информатике — степень неполноты, неопределённости знаний.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
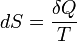 ,
,
где 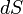 — приращение энтропии;
— приращение энтропии; 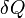 — минимальная теплота, подведенная к системе; T — абсолютная температура процесса
— минимальная теплота, подведенная к системе; T — абсолютная температура процесса
38)Термодинамическая вероятность
Термодинамическая вероятность — число способов, которыми может быть реализовано состояние физической системы. В термодинамике состояние физической системы характеризуется определёнными значениями плотности, давления, температуры и др. измеримых величин. Перечисленные величины определяют состояние системы в целом (её макросостояние). Однако при одной и той же плотности, температуре и т. д. частицы системы могут различными способами распределиться в пространстве и иметь различные импульсы. Каждое данное распределение частиц называется микросостоянием системы. Вероятность термодинамическая (обозначается W) равна числу микросостояний, реализующих данное макросостояние, из чего следует, что 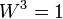 . Вероятность термодинамическая связана с одной из основных макроскопических характеристик системы энтропией S соотношением Больцмана:
. Вероятность термодинамическая связана с одной из основных макроскопических характеристик системы энтропией S соотношением Больцмана: 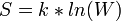 , где
, где 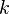 — постоянная Больцмана.
— постоянная Больцмана.
Вероятность термодинамическая не является вероятностью в математическом смысле. Она применяется в статистической физике для определения свойств систем, находящихся в термодинамическом равновесии (для них Вероятность термодинамическая имеет максимальное значение). Для расчёта Вероятность термодинамическая существенно, считаются ли частицы системы различимыми или неразличимыми. Поэтому классическая и квантовая механика приводят к разным выражениям для Вероятность термодинамическая
39)Статистический смысл энтропии
осмотрим на энтропию с другой стороны.
Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами.
Состояние же системы, характеризуемое состоянием каждой входящей в систему молекулы, называют микросостоянием.
Так как молекулы движутся хаотически, то имеется много микросостояний, соответствующих одному макросостоянию. Обозначим W - число микросостояний, соответствующее данномумакросостоянию (как правило, W >> 1).
Термодинамической вероятностью или статистическим весом макросостояния W - называется число микросостояний, осуществляющих данное макросостояние (или число перестановок одноименных элементов, при которых сохраняется данное макросостояние).
Термодинамическая вероятность W - максимальна, когда система находится в равновесном состоянии.
В состоянии равновесия и термодинамическая вероятность максимальна, и энтропия максимальна. Из этого можно сделать вывод, что между ними существует связь.
Энтропия S – аддитивная величина: 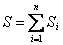 , где
, где 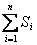 - сумма энтропий тел, входящих в систему.
- сумма энтропий тел, входящих в систему.
Вероятность сложного события, есть произведение вероятностей состояний:
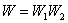 , , |
где W1 – первое состояние; W2 – второе состояние.
Аддитивной величиной является логарифм термодинамической вероятности:
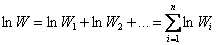 . . |
Поэтому Л. Больцман предложил:
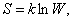 , , | (6.7.1) |
где k – коэффициент Больцмана. С этой точки зрения энтропия выступает, как мера беспорядочности, хаотичности состояния.
Например, в ящике черные и белые шары. Они порознь, есть порядок и W невелика. После встряхивания – шары перемещаются, W увеличивается и энтропия тоже. И сколько бы не встряхивать потом ящик, никогда черные шары не соберутся у одной стенки, а белые у другой, хотя эта вероятность не равна нулю.
Связь между S и W позволяет несколько иначе сформулировать второе начало термодинамики: наиболее вероятным изменением энтропии является ее возрастание.
Энтропия – вероятностная статистическая величина. Утверждение о возрастании энтропии потеряло свою категоричность. Её увеличение вероятно, но не исключаются флуктуации.
На основе этих рассуждений Р. Клаузиус в 1867 г. и выдвинул гипотезу о тепловой смерти Вселенной (о ней сказано ранее).
Л. Больцман один из первых опроверг эту гипотезу и показал, что закон возрастания энтропии – статистический закон, т.е. возможны отклонения.
Российские физики Я.Б. Зельдович и И.Д. Новиков так же опровергли эту теорию и показали, что Р. Клаузиус не учел, что Вселенная не стационарна и в будущем не перейдет к одному состоянию, так как она эволюционирует, не остается статичной.
Энтропия замкнутой системы – максимальна, при достижении системой равновесного состояния.
40)Приведенное количество теплоты
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основныхтермодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Единица измерения в Международной системе единиц (СИ): Джоуль.
Или
осмотрим на энтропию с другой стороны.
Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами.
Состояние же системы, характеризуемое состоянием каждой входящей в систему молекулы, называют микросостоянием.
Так как молекулы движутся хаотически, то имеется много микросостояний, соответствующих одному макросостоянию. Обозначим W - число микросостояний, соответствующее данномумакросостоянию (как правило, W >> 1).
Термодинамической вероятностью или статистическим весом макросостояния W - называется число микросостояний, осуществляющих данное макросостояние (или число перестановок одноименных элементов, при которых сохраняется данное макросостояние).
Термодинамическая вероятность W - максимальна, когда система находится в равновесном состоянии.
В состоянии равновесия и термодинамическая вероятность максимальна, и энтропия максимальна. Из этого можно сделать вывод, что между ними существует связь.
Энтропия S – аддитивная величина: 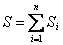 , где
, где 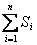 - сумма энтропий тел, входящих в систему.
- сумма энтропий тел, входящих в систему.
Вероятность сложного события, есть произведение вероятностей состояний:
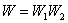 , , |
где W1 – первое состояние; W2 – второе состояние.
Аддитивной величиной является логарифм термодинамической вероятности:
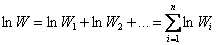 . . |
Поэтому Л. Больцман предложил:
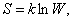 , , | (6.7.1) |
где k – коэффициент Больцмана. С этой точки зрения энтропия выступает, как мера беспорядочности, хаотичности состояния.
Например, в ящике черные и белые шары. Они порознь, есть порядок и W невелика. После встряхивания – шары перемещаются, W увеличивается и энтропия тоже. И сколько бы не встряхивать потом ящик, никогда черные шары не соберутся у одной стенки, а белые у другой, хотя эта вероятность не равна нулю.
Связь между S и W позволяет несколько иначе сформулировать второе начало термодинамики: наиболее вероятным изменением энтропии является ее возрастание.
Энтропия – вероятностная статистическая величина. Утверждение о возрастании энтропии потеряло свою категоричность. Её увеличение вероятно, но не исключаются флуктуации.
На основе этих рассуждений Р. Клаузиус в 1867 г. и выдвинул гипотезу о тепловой смерти Вселенной (о ней сказано ранее).
Л. Больцман один из первых опроверг эту гипотезу и показал, что закон возрастания энтропии – статистический закон, т.е. возможны отклонения.
Российские физики Я.Б. Зельдович и И.Д. Новиков так же опровергли эту теорию и показали, что Р. Клаузиус не учел, что Вселенная не стационарна и в будущем не перейдет к одному состоянию, так как она эволюционирует, не остается статичной.
Энтропия замкнутой системы – максимальна, при достижении системой равновесного состояния.
41)Второе начало термодинамики
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Формулировки
Существуют несколько эквивалентных формулировок второго начала термодинамики:
· Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
· Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло 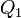 у нагревателя, отдав
у нагревателя, отдав 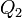 холодильнику и совершив при этом работу
холодильнику и совершив при этом работу 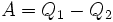 . После этого воспользуемся процессом Клаузиуса и вернем тепло
. После этого воспользуемся процессом Клаузиуса и вернем тепло 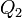 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
· «Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа ЮлиусаКлаузиуса (R. J. Clausius, 1865) имеет следующий вид[2]:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния 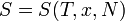 , называемая энтропией, такая, что ее полный дифференциал
, называемая энтропией, такая, что ее полный дифференциал 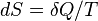 .
.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
42)Третье начало термодинамики
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры кабсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Формулировка
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
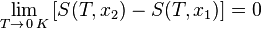
или
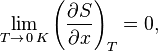
где 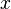 — любой термодинамический параметр.
— любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение):
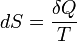 ,
,
третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики). В классической термодинамике энтропия может быть определена лишь с точностью до произвольной аддитивной постоянной  , что не мешает термодинамическим исследованиям, так как реально измеряется разность энтропий
, что не мешает термодинамическим исследованиям, так как реально измеряется разность энтропий  в различных состояниях. Согласно третьему началу термодинамики, при
в различных состояниях. Согласно третьему началу термодинамики, при  значение
значение 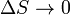 .
.
В 1911 году Макс Планк сформулировал третье начало термодинамики как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю: 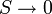 . Отсюда
. Отсюда 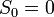 , что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность
, что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность 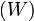 состояния системы
состояния системы 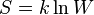 . При абсолютном нуле температуры система находится в основном квантово-механическом состоянии. Если оно невырожденно, то
. При абсолютном нуле температуры система находится в основном квантово-механическом состоянии. Если оно невырожденно, то 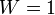 (состояние реализуется единственным микрораспределением) и энтропия
(состояние реализуется единственным микрораспределением) и энтропия 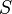 при
при 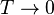 равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем могут стать существенными дискретность квантовых уровней макроскопической системы и влияние квантового вырождения.
равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем могут стать существенными дискретность квантовых уровней макроскопической системы и влияние квантового вырождения.
43)Тепловыедвигателиихолодильныемашины
Достоинством тепловых насосов как нагревательной техники является возможность иногда получать больше теплоты, чем расходуется энергии на их работу; аналогичным образом холодильная машина может отвести от охлаждаемого конца больше теплоты, чем затрачивается на организацию процесса.
Эффективность таких тепловых машин характеризуют холодильный коэффициент (для холодильных машин) или коэффициент трансформации (для тепловых насосов)
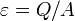 ,
,
где 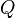 — тепло, отбираемое от холодного конца (в холодильных машинах) или передаваемое к горячему (в тепловых насосах);
— тепло, отбираемое от холодного конца (в холодильных машинах) или передаваемое к горячему (в тепловых насосах); 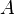 — затрачиваемая на этот процесс работа (или электроэнергия). Наилучшими показателями производительности для таких машин обладает обратный цикл Карно: в нём холодильный коэффициент
— затрачиваемая на этот процесс работа (или электроэнергия). Наилучшими показателями производительности для таких машин обладает обратный цикл Карно: в нём холодильный коэффициент
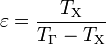 ,
,
гд<

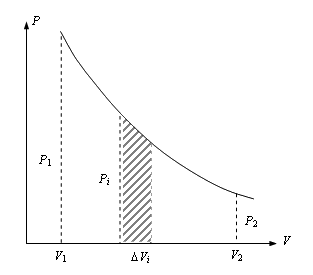 Рис. 4.9
Рис. 4.9 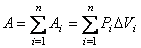 . Давление моля идеального газа, как следует из уравнения состояния, равно
. Давление моля идеального газа, как следует из уравнения состояния, равно 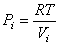 .
. 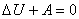 .
. 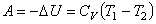 .
. 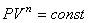 ,
,