Способы изменения внутренней энергии термодинамической системы. Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам.
Термодинамика - раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника.
В термодинамике имеют дело не с отдельными молекулами, а с макроскопическими телами, состоящими из огромного числа частиц. Эти тела называются термодинамическими системами. В термодинамике тепловые явления описываются макроскопическими величинами — давление, температура, объём, …, которые не применимы к отдельным молекулам и атомам.
Два способа изменения внутренней энергии - теплопередача и совершение механической работы. Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. При механическом взаимодействии тел мерой энергии, переданной от одного тела к другому, является работа А.
При осуществлении теплопередачи от одного тела к другому мерой переданной энергии является количество теплоты Q.
Совершение механической работы называется макроскопическим способом передачи энергии, а теплопередача — микроскопическим.
Первый закон термодинамики. Рассмотрим три тела — 1,2 и 3. Пусть между телом 1 и телом 2 осуществляется теплопередача, а между телом 1 и телом 3 происходит механическое взаимодействие.
При теплопередаче количества теплоты Q внутренняя энергия тела 2 изменится на 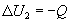 , а внутренняя энергия тела 3 в результате совершения работы изменится на
, а внутренняя энергия тела 3 в результате совершения работы изменится на 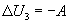 . В результате теплопередачи и механического взаимодействия внутренняя энергия каждого из трех тел изменится, но в изолированной термодинамической системе, в которую входят все три тела, по закону сохранения и превращения энергии внутренняя энергия U остается неизменной. Следовательно, сумма изменений внутренней энергии тел 1, 2 и 3 равна нулю:
. В результате теплопередачи и механического взаимодействия внутренняя энергия каждого из трех тел изменится, но в изолированной термодинамической системе, в которую входят все три тела, по закону сохранения и превращения энергии внутренняя энергия U остается неизменной. Следовательно, сумма изменений внутренней энергии тел 1, 2 и 3 равна нулю:
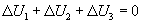 .
.
Отсюда изменение внутренней энергии тела 1 равно сумме изменений внутренней энергии взаимодействующих с ним тел 2 и 3, взятой с противоположным знаком:
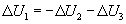
Так как тело 1 является неизолированной термодинамической системой, можно сделать общий вывод: в неизолированной термодинамической системе изменение внутренней энергии 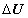 равно сумме количества теплоты Q, переданного системе, и работы А внешних сил:
равно сумме количества теплоты Q, переданного системе, и работы А внешних сил:
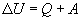
Это выражение закона сохранения и превращения энергии называется первым законом термодинамики.
Вместо работы А, совершаемой внешними силами над термодинамической системой, часто удобнее бывает рассматривать работу A', совершаемую термодинамической системой над внешними телами. Так как эти работы равны по абсолютному значению, но противоположны по знаку:
A = - A',
то первый закон термодинамики имеет второе выражение
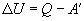
Первое начало термодинамики, один из двух основных законов термодинамики, представляет собой закон сохранения энергии для систем, в которых существенное значение имеют тепловые процессы. П. н. т. было сформулировано в середине 19 в. в результате работ Ю. Р. Майера, Дж. Джоуля и Г. Гельмгольца. Согласно П. н. т., термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. П. н. т. часто формулируют как невозможность существования вечного двигателя 1-го рода, который совершал бы работу, не черпая энергию из какого-либо источника.
При сообщении термодинамической системе некоторого количества теплоты Q в общем случае происходит изменение внутренней энергии системы DU и система совершает работу А:
Q = DU + A (1)
Уравнение (1), выражающее П. н. т., является определением изменения внутренней энергии системы (DU), так как Q и А — независимо измеряемые величины.
Внутреннюю энергию системы U можно, в частности, найти, измеряя работу системы в адиабатном процессе (то есть при Q = 0): Аад = — DU, что определяет U с точностью до некоторой аддитивной постоянной U0:
U = U + U0 (2)
Изохорный процесс (V=const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 1), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
Изобарный процесс (p = const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, которая параллельна оси V. При изобарном процессе работа газа при увеличения объема от V1 до V2 равна
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта:
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Термодинамический процесс - изменение макроскопического состояния термодинамической системы.
Адиабатный процесс — происходящий без теплообмена с окружающей средой;
Изохорный процесс — происходящий при постоянном объёме;
Изобарный процесс — происходящий при постоянном давлении;
Изотермический процесс — происходящий при постоянной температуре;
Изоэнтропийный процесс — происходящий при постоянной энтропии;
Изоэнтальпийный процесс — происходящий при постоянной энтальпии;
Политропный процесс — происходящий при постоянной теплоёмкости;
