Средняя кинетическая энергия частиц газа
Оказывается, что ключевую роль в описании идеального газа играет средняя кинетическая энергия его частиц.
Частицы газа двигаются с разными скоростями. Пусть в газе содержится N частиц, скорости которых равны v1,v2,...,vN. Масса каждой частицы равна m0. Кинетические энергии частиц:
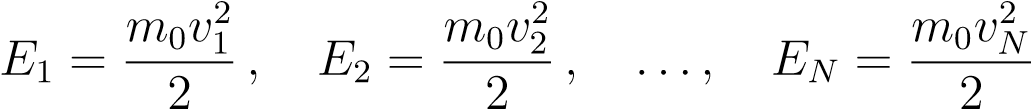 .
.
Средняя кинетическая энергия E частиц газа — это среднее арифметическое их кинетических энергий:
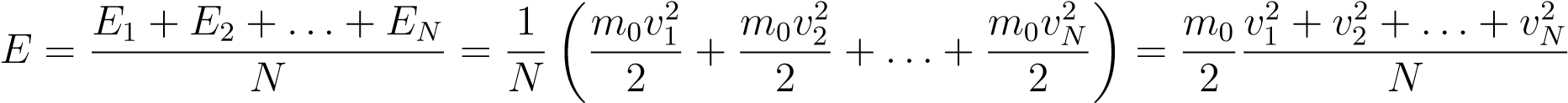 .
.
Последний множитель — это средний квадрат скорости, обозначаемый просто v2:
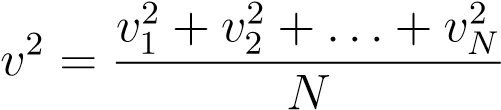 .
.
Тогда формула для средней кинетической энергии приобретает привычный вид:
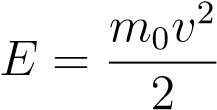 . (1)
. (1)
Корень из среднего квадрата скорости называется средней квадратической скоростью:
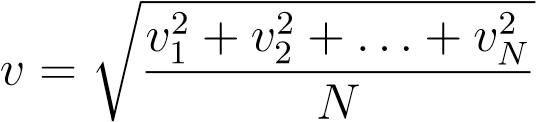 .
.
Основное уравнение МКТ идеального газа
Cвязь между давлением газа и средней кинетической энергией его частиц называется основным уравнением молекулярно-кинетической теории идеального газа. Эта связь выводится из законов механики и имеет вид:
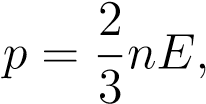
где n — концентрация газа (число частиц в единице объёма). С учётом (1) имеем также:
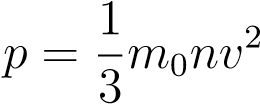 .
.
Что такое m0n? Произведение массы частицы на число частиц в единице объёма даёт массу единицы объёма, то есть плотность: m0n = ρ. Получаем третью разновидность основного уравнения:
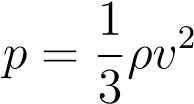 .
.
Энергия частиц и температура газа
Можно показать, что при установлении теплового равновесия между двумя газами выравниваются средние кинетические энергии их частиц. Но мы знаем, что при этом становятся равны и температуры газов. Следовательно, температура газа — это мера средней кинетической энергии его частиц.
Собственно, ничто не мешает попросту отождествить эти величины и сказать, что температура газа — это средняя кинетическая энергия его молекул. В продвинутых курсах теоретической физики так и поступают. Определённая таким образом температура измеряется в энергетических единицах — джоулях.
Но для практических задач удобнее иметь дело с привычными кельвинами. Связь средней кинетической энергии частиц и абсолютной температуры газа даётся формулой:
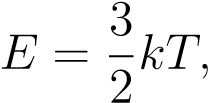 (2)
(2)
где k = 1,38 · 10−23 Дж/К — постоянная Больцмана.
Из данной формулы можно получить выражение для средней квадратической скорости частиц. Подставим (1) в (2):
откуда 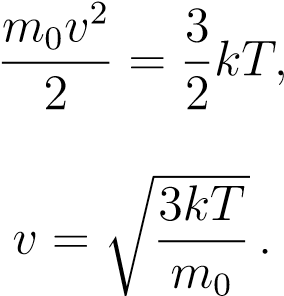
В эту формулу входит масса частицы m0, которую ещё надо вычислить. Но можно получить более удобный вариант формулы, домножив числитель и знаменатель подкоренного выражения на число Авогадро NA:
 r3kNA
r3kNA
.
m0NA
В знаменателе имеем: m0NA = µ — молярная масса газа. В числителе стоит произведение двух констант, которое также является константой:
Дж Дж
−23 23 −1
R = kNA = 1,38 · 10 · 6,02 · 10 моль = 8,31 .
К моль · К
Константа R называется универсальной газовой постоянной.
Теперь формула для средней квадратической скорости приобретает вид:
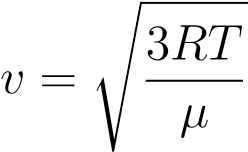 .
.
Такое выражение гораздо более удобно для практических вычислений.
