Дифференциальное уравнение электромагнитных волн.
Можно показать, что для однородной и изотропной среды вдали от зарядов и токов, создающих электромагнитное поле, из уравнений Максвелла следует, что векторы напряженностей Е и Н переменного электромагнитного поля удовлетворяют волновому уравнению типа

МКТ.
Основные положения МКТ 1. Все вещества состоят из мельчайших частиц (молекул и атомов). Молекулы разделены промежутками.2. Молекулы находятся в беспрерывном хаотическом движении.3. Между молекулами существуют силы взаимодействия (притяжение и отталкивание).
Средняя кинетическая энергия молекул идеального газа. W=mv²/2=3/2кт
Молекулярно-кинетический смысл температуры. Таким образом, оказывается, что средняя кинетическая энергия хаотического движения молекул идеального газа прямо пропорциональна его абсолютной температуре и является мерой интенсивности теплового движения молекул при заданной температуре
Основное уравнение МКТ Ek=3\2RT; P=2/3n<E0>
Модель идеального газа.Идеа́льный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Закон Авогадро. Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в одинаковых объёмах различных паров и газов при одинаковых условиях (температуре и давлении) находится одинаковое число частиц».
Закон Дальтона.Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.
Распределение Максвелла.Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Средняя квадратичная скорость
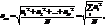
где ui – скорость i–той молекулы, N – число молекул.
Среднее значение кинетической энергии поступательного движения молекулы
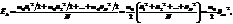
где m0 – масса одной молекулы.
Основное уравнение молекулярно-кинетической теории
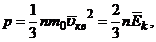
где n – концентрация молекул.
Уравнение состояния идеального газа
p = nkT,
где k – постоянная Больцмана.
Из этих уравнений следует
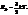
В состоянии термодинамического равновесия в газе устанавливается некоторое стационарное равновесное состояние, когда число молекул в заданном интервале скоростей сохраняется постоянным. Функция распределения молекул по скоростям
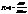 ,
,
где dN– число молекул, скорости которых заключены в интервале du (от u до u+ du), N– общее число молекул.
Закон Максвелла для распределения молекул идеального газа по скоростям
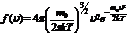 .
.
Распределение Больцмана для частиц во внешнем потенциальном поле
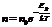 ,
,
где n – концентрация частиц в точках поля, где потенциальная энергия частицы равна Ep, n0– концентрация частиц в точках поля, где Ep=0.
