Внутренняя энергия. Работа. Теплота.
| |
Полная энергия системы состоит из трех видов энергии: кинетической энергии движения системы как целого объекта, потенциальной энергии, обусловленной положением системы в каком-либо внешнем поле, и внутренней энергии. Обычно химические реакции протекают в стационарных установках при отсутствии электрических и магнитных полей, а воздействие гравитационного поля Земли на химические реакции является столь малым, что не может быть экспериментально установлено. В этом случае изменения кинетической и потенциальной энергии можно не учитывать и считать, что изменение полной энергии системы определяется лишь изменением ее внутренней энергии.
Внутренняя энергия U представляет собой сумму четырех слагаемых, каждое из которых характеризует определенный вид движения в системе: кинетическую энергию движения (поступательного, вращательного, колебательного) структурных частиц (Eк), потенциальную энергию межмолекулярного взаимодействия (Еп), химическую энергию внутримолекулярной химической связи (Ех), атомную энергию взаимодействия нуклонов в ядрах (Еа):
U = Eк + Еп + Ех + Еа
Поскольку в химических реакциях ядерные перестройки не происходят, Еа системы постоянна, а изменяются кинетическая, потенциальная и химическая энергии. Поэтому при переходе из начального состояния системы (1), от исходных веществ (реагентов) в конечное (2), к продуктам реакции изменение внутренней энергии будет равно:
∆U = U2 - U1 = ∆Eк +∆Еп +∆Еx
Абсолютные значения U1 и U2 неизвестны, поэтому можно судить только о суммарном изменении внутренней энергии системы ∆U, по обмену внутренней энергии системы с внешней средой и таким формам обмена энергией, как теплота и работа.
Теплота — результат изменения внутренней энергии, характеризующий передачу хаотического поступательного, колебательного и вращательного движения от структурных частиц системы к частицам внешней среды (или наоборот) путем теплопроводности, излучения или конвекции. Такую передачу энергии называют теплопередачей. Количественно изменение внутренней энергии в процессе теплопередачи оценивают количеством переданной теплоты q.
Теплопередача возможна только при наличии разности температур системы и внешней среды. Для экзотермических реакций, идущих с выделением теплоты, когда температура системы больше,
чем внешней среды, система теряет энергию и q < 0. Для эндотермических реакций, идущих с поглощением теплоты извне, от внешней среды, значение теплоты положительное и q > 0. Если внешняя среда представляет собой вакуум, то теплообмен не происходит и q = 0, внутренняя энергия системы остается без изменения, т. е. ∆U= 0. При равенстве температур системы и внешней среды ∆T = 0 и q = 0. Однако это не говорит об отсутствии теплопередачи, она будет происходить, но так, что количество поглощенной теплоты в единицу времени равно количеству выделенной. В этом случае говорят о состоянии теплового равновесия между системой и внешней средой.
С понятием «теплота» тесно связано другое понятие «температура». Температура представляет собой термодинамический параметр, характеризующий энергетическое состояние частиц, вещества или системы. В отличие от объема, экстенсивного свойства системы, температура относится к интенсивным свойствам, она не следует закону аддитивности. Нельзя, слив в один стакан несколько пробирок воды с одинаковой температурой, получить воду с более высокой температурой. Число, которым характеризуют температуру, надо рассматривать как единое целое: 1000С не является суммой ста единичных градусов Цельсия.
Работа — результат изменения внутренней энергии, характеризующий передачу упорядоченного поступательного движения от организованного потока частиц системы к частицам внешней среды (или наоборот) с созданием в ней такого же организованного, поступательно движущегося потока частиц. Количество совершенной в этом процессе работы A определяет изменение внутренней энергии. В химических реакциях обычно изменяется объем газообразных реагентов и продуктов реакции и совершается работа расширения или сжатия системы.
Работа расширения или сжатия при постоянном внешнем давлении окружающей среды (р = const) равна
Ам = р(V2 —V1)= p∆V,
где Ам — механическая работа; V1 и V2 — объемы системы соответственно после окончания и до начала химической реакции.
Если V2 > V1, система расширяется, работа будет положительной (Aм>0) и тем больше, чем выше внешнее постоянное давление р. Если система расширяется в вакуум, работа отсутствует, р = 0 и Ам = p∆V =0.
Если V2 < V1, система в результате химической реакции сжимается, работа Ам < 0, это означает, что система «вынуждает» внешнюю среду произвести над собой работу сжатия.
В целом если система одновременно участвует в двух процессах — теплопередаче и работе — для расчета изменения внутренней энергии ∆U, необходимо измерить значения обеих величин: q и A.
Теплота и работа есть следствие обмена движением микрочастиц системы и внешней среды. Теплота и работа характеризуют не систему, а временные процессы передачи движения, его преобразования. Как только закончилась химическая реакция и внутренняя энергия системы приобрела свое новое значение, процессы теплопередачи и совершения работы заканчиваются. Значения q и A нужны лишь для того, чтобы определить изменения внутренней энергии системы. Поэтому такие выражения, как «тепловая энергия», «теплосодержание», «передача энергии», не имеют физического смысла. Веществу присуще только движение, энергия же - математическая характеристика этого движения, его мера. Конечно, не мера запасена в веществе и не мера передается от системы к системе. Движение — общее свойство материи, и только само движение может передаваться или превращаться в другие свои виды.
О теплоте и работе можно говорить только в момент передачи движения от системы или к системе, но не в связи с ее состоянием. Теплота, как и работа, не являются свойствами системы, их значение зависит от пути перехода системы из начального состояния в конечное. Внутри системы нет ни «теплоты», ни «работы».
Существует три типа систем по характеру их обмена движением с внешней средой: изолированные, закрытые (или замкнутые) и открытые.
Изолированной системой называют систему, масса и энергия которой неизменны. Это означает, что передача вещества и движения через оболочку .такой системы исключена. Практически абсолютно изолированных систем не существует. В первом приближении к таким системам можно отнести запаянную ампулу с хорошей теплоизоляцией.
Закрытой называют систему, масса которой постоянна, а энергия может меняться. Такая система не препятствует процессам теплопередачи и работы, но через ее оболочку не происходит перенос
вещества. Разновидностью закрытой системы, является адиабатическая система, у которой через гибкую оболочку теплопередачи не происходит, но изменение внутренней энергии системы возможно за счет совершения работы.
Открытые системы способны изменять как свою массу, так и энергию.
Первое начало термодинамики
Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
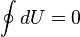
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты  , сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества
, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества 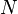 при химическом потенциале
при химическом потенциале 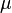 , и работы
, и работы 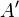 [3], совершённой над системой внешними силами и полями, за вычетом работы
[3], совершённой над системой внешними силами и полями, за вычетом работы  , совершённой самой системой против внешних сил
, совершённой самой системой против внешних сил
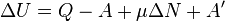 .
.
Для элементарного количества теплоты 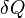 , элементарной работы
, элементарной работы  и малого приращения
и малого приращения 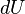 внутренней энергии первый закон термодинамики имеет вид:
внутренней энергии первый закон термодинамики имеет вид:
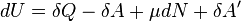 .
.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что 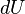 и
и 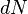 являются полными дифференциалами, а
являются полными дифференциалами, а  и
и 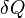 — нет.
— нет.
