Методика измерения показателей преломления
Перед началом измерений рефрактометр, подключённый к водяному термостату, настроенному на 25°C, термостатируют в течение 15 – 20 мин., контролируя температуру по термометру рефрактометра.
Убеждаются в отсутствии на поверхности призм загрязнений и царапин, затем 2 – 3 капли исследуемого раствора при помощи стеклянной палочки помещают на поверхность измерительной призмы, и плавно! опускают крышку рабочей камеры.
Включают осветительную лампу и направляют луч света в окно осветительной призмы.
Глядя в окуляр и вращая ручку с окуляром, находят границу светотени. Вращая ручку дисперсионного компенсатора, устраняют спектральную окраску светотени и, вращая окуляр, добиваются резкого изображения этой границы.
Вращая ручку с окуляром, совмещают перекрестие с границей светотени и производят отсчёт показателя преломления.
С целью проверки правильности настройки рефрактометра, производят измерение показателя преломления дистиллированной воды. При правильной настройке рефрактометра показатель преломления воды при 25°C должен быть равен 1,3285.
При замене измеряемой жидкости поверхности призм тщательно протирают медицинской ватой. При исследовании вязких нелетучих жидкостей вату смачивают дистиллированной водой или спиртом, а затем протирают поверхности призм сухой ватой.
После окончания измерений между поверхностями призм помещают слой чистой сухой ваты.
Методика проведения работы
Порядок проведения эксперимента
1. В колбах с притёртыми пробками готовят смеси этилового спирта с водой, в соответствии с одним из вариантов (таблица 2.1.). Объёмы жидкостей отмеряются мерным цилиндром и пипеткой.
2. Смеси перемешивают, выстаивают в течение 10 мин для завершения сольватационных процессов и измеряют их показатели преломления. Результаты измерений заносят в таблицу (таблица 2.2).
3. 
Смесь с наибольшим содержанием этанола помещают в сухую круглодонную колбу, в неё же опускают кусочек пористой керамики для обеспечения равномерности кипения и собирают установку для определения температур кипения и состава газообразной фазы – Рис. 2.7.
При сборе установки колба устанавливается в электроколбонагреватель, а холодильник подключается к водопроводу.
4. Включают колбонагреватель и следят за моментом начала перегонки.
5. В момент начала перегонки (появление первых капель конденсата) фиксируют показания термометра и заносят их в таблицу 2.2.
6. Когда объём конденсата достигнет ~ 1см3, выключают нагреватель и дожидаются завершения процесса кипения.
7. Определяют показатель преломления отогнанного дистиллята. Результаты измерений заносят в таблицу 2.2.
8. После остывания разбирают установку. Остатки раствора выливают в специальную склянку для сливов. Ополаскивают колбу небольшим количеством следующей смеси и повторяют опыт.
Таблица 2.1. Состав исследуемых смесей этанол – вода
| Вариант | Смесь 1 | Смесь 2 | Смесь 3 | |||
| V(этанола), см3 | V(H2O), см3 | V(этанола), см3 | V(H2O), см3 | V(этанола), см3 | V(H2O), см3 | |
| I | 5,1 | 18,2 | 10,2 | |||
| II | 11,7 | 15,8 | 3,3 |
Обработка результатов эксперимента
1. По данным показателей преломления по графику зависимости n = f(w(A)) определяют составы жидкой и газообразной фазы для смесей всех составов. Результаты заносят в таблицу 2.2.
Таблица 2.2. Результаты исследования состава фаз и температур кипения смесей этанол – вода. (образец)
| Смесь | Жидкая фаза | Газовая фаза | tКИП, °C | ||
| n | w (этанола) | n | w (этанола) | ||
2. В таблицу 2.2 заносятся также результаты другого варианта работы.
3. На миллиметровой бумаге строят график зависимости температур кипения от состава жидкой и газообразной фазы (диаграмма кипения). Температуры кипения чистых компонентов берут из справочной литературы.
В выводе необходимо указать какая система, и каким методом была исследована в работе. Что было получено в результате работы. К какому типу диаграмм кипения относится полученная диаграмма.
Вопросы к лабораторной работе №2
1. Дайте определения понятий „компоненты системы”, „число компонентов системы”, „фаза”, „число внешних параметров”, „число степеней свободы”.
2. Сформулируйте правило фаз Гиббса.
3. Какие растворы называются идеальными?
4. Сформулируйте закон Рауля.
5. Какой процесс называется процессом кипения?
6. Каким образом изменяются температуры кипения чистых жидкостей и бинарных жидких смесей в процессе кипения?
7. Диаграммы кипения. Виды диаграмм кипения. Азеотропные смеси.
8. Каким образом по диаграмме кипения можно определить температуру начала кипения смеси заданного состава?
9. Какая линия называется нодой? Каким образом можно определить состав фаз в гетерогенной области диаграммы?
10. Правило рычага. Каким образом можно рассчитать отношение масс фаз, находящихся в равновесии?
11. В чём заключается сущность метода ректификации?
12. Каким образом метод ректификации применяется в пищевой промышленности?
13. Какие существуют разновидности способов перегонки?
14. Какое явление называется поляризацией молекул?
15. Что такое преломление света? Каковы причины этого явления?
16. На чём основан рефрактометрический метод определения состава смесей?
Лабораторная работа № 3
Коэффициент распределения
Цель работы: Исследование распределения вещества между двумя жидкими фазами. Определение коэффициента распределения бензойной кислоты между водой и бензолом (толуолом), расчёт постоянной уравнения Шилова.
Общие сведения
Химическим потенциалом компонента называется доля энергии Гиббса системы, приходящаяся на один моль данного компонента.
Химический потенциал данного компонента равен частной производной от общей энергии Гиббса системы по числу молей данного компонента, при постоянном давлении, температуре и числе молей всех остальных компонентов:
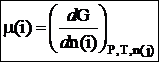
Полный дифференциал энергии Гиббса системы равен сумме произведений химических потенциалов компонентов, входящих в состав системы на дифференциалы числа молей каждого компонента:
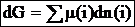
Зависимость химического потенциала от активности компонента описывается уравнением:
m(i) = m0(i) + RT ln a(i)
где m0(i) – стандартный химический потенциал компонента i; a(i) – активность компонента i;
Стандартным химическим потенциаломназывается химический потенциал данного компонента при его активности в данной системе равной 1. Величина стандартного химического потенциала зависит от природы компонента, от состава данной системы и от температуры.
