По лабораторным работам по общей химии
Студента________________________________________________
(группа, курс) (фамилия, имя, отчество)
Принял преподаватель______________________________________
(фамилия, имя, отчество)
______________________________________
(дата) (подпись)
Волгодонск 2015 г.
ЛАБОРАТОРНАЯ РАБОТА №1
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА (ЭКВИВАЛЕНТНОЙ МАССЫ) МЕТАЛЛА ПО ОБЪЁМУ ВЫТЕСНЕННОГО ВОДОРОДА
Ц е л ь р а б о т ы: Ознакомиться с методикой определения и расчёта молярной массы эквивалента металлов.
О б о р у д о в а н и е и м а т е р и а л ы: штатив, две бюретки на 50 см3, пробирка с газоотводной трубкой, термометр, барометр, аналитические весы и разновесы; навеска металла около 0,01 г; 2,5 М раствор НС1.
Методика выполнения работы
По объёму вытесненного водорода можно определить молярные массы эквивалентов активных металлов (магния, алюминия, цинка и т.д.), способных вытеснять водород из разбавленных кислот.
Прибор для определения молярной массы эквивалента металлов изображён на рис. 1.1. и состоит из:
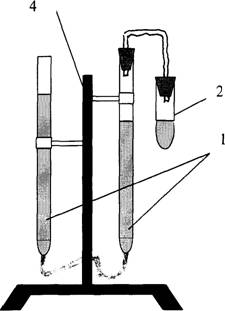 |
1) двух бюреток на 50 см3, соединённых резиновой трубкой;
2) реакционной пробирки;
3) газоотводной трубки;
4) штатива.
Налить в пробирку 4-5 см3 2,5 М раствора хлористоводородной кислоты, 5 капель раствора Со(NO3)2 – катализатора. Навеску металла количественно перенести в пробирку c кислотой, которую плотно присоединить к прибору. Тотчас начинается выделение водорода и вода вытесняется из правой бюретки в левую. Пока идёт реакция, записать показания барометра и термометра; по табл. 1 определить давление насыщенных паров воды.Когда весь металл растворится, прекратится понижение уровня воды в бюретке. Окончательный точный отсчёт показаний бюретки производится после охлаждения пробирки до комнатной температуры (через 3-5мин.).
Результаты измерений записывают по форме:
Масса металла, m=..., г
Показания бюретки до проведения реакции V1=..., см3
Показания бюретки после реакции V2=..., см3
Объём выделившегося водорода VH2 =V2 – V1=..., см3
Температура окружающей среды t=..., ° С; Т=273 +t= ..., К
Атмосферное давление Р=..., Па
Давление насыщенных паров воды 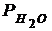 = ..., Па
= ..., Па
Парциальное давление водорода 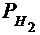 =
= 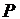 -
- 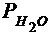 = ..., Па
= ..., Па
Объём выделившегося водорода приводят к нормальным условиям на основании уравнения состояния идеального газа, объединяющего законы Бойля-Мариотта и Гей-Люссака:
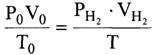
где P0 - нормальное давление, равное 101325 Па; Vo - объём газа при нормальных условиях, см3; То - 273 К; 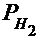 - парциальное давление сухого водорода;
- парциальное давление сухого водорода; 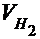 - объём газа в условиях опыта; Т - температура опыта по абсолютной шкале температур.
- объём газа в условиях опыта; Т - температура опыта по абсолютной шкале температур.
Таким образом, объём водорода, приведённый к нормальным условиям, определяется по уравнению:
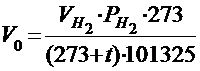 ;
;
По закону эквивалентов в случае, когда одно из реагирующих веществ находится в твёрдом состоянии, а второе - в газообразном, молярная масса эквивалента металла определяется по формуле:
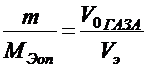
где m - масса металла; МЭоп - молярная масса эквивалента металла; Vo -объём газа, приведённый к нормальным условиям; Vэ - молярный объём эквивалента газа.Молярный объём эквивалента водорода, составляющий 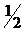 объёма его моля, занимает при нормальных условиях 11200 см3/моль.
объёма его моля, занимает при нормальных условиях 11200 см3/моль.
Таблица 1.
Давление насыщенного водяного пара в равновесии с водой

Затем студенты вычисляют теоретическую величину молярной массы эквивалента металла и находят относительную ошибку определения:
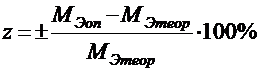
В конце работы записываются выводы.
Общий вывод по работе:
| Работу выполнил Студент группы | Работу принял Преподаватель | Дата | ||
Контрольные вопросы.
1. Что называется молярной массой эквивалента элемента? В каких единицах измеряется молярная масса эквивалента?
2.. Сформулируйте закон эквивалентов. Выразите его математически.
3. Какие факторы оказывают влияние на точность определения молярной массы эквивалента металла при взаимодействии его с кислотой?
Лабораторная работа №2
