Физическое состояние вещества
В природе вещества встречаются в трех состояниях: в твердом, жидком и газообразном.
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.Структура твердых тел многообразна, но, тем не менее, их можно разделять на кристаллы и аморфные тела.
Законы идеальных газов.
Бойля-Мариотта- При постоянной температуре и массеидеального газа произведение его давления и объёма постоянно. PV=const
Гей-Люсака- При постоянном давлении объем идеального газа изменяется прямопропорционально повышению температуры.
V= 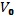 (1+αT), где V-уд. V при темп и давл,
(1+αT), где V-уд. V при темп и давл, 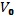 -уд.объем при t=0 и P, α-коэф теплового расширения.
-уд.объем при t=0 и P, α-коэф теплового расширения.
Клайперона- PV=RT, уд.газовая постоянная
Клайперона Менделеева PV=MRT
Закон Авога́дро — закон, согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул
Смеси жидкостей, паров и газов. Закон Дальтона.
Состав смеси обычно определяют посредством нахождения массовой или мольной концентрации компонентов, входящих в смесь.
Массовая :
Мольная:
Дальтон: Общее давление идеального газа равно сумме отдельных парциальных его компонентов. Каждый компонент смеси равен температуре равное температуре смеси. P= 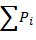
Понятие теплоемкости.
Теплоемкость тела – количества тепла необходимиго для нагрева единицы вещества на 1 градус в определенном процессе
Cz= 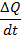
- массовую (удельную) теплоемкость
- объемную теплоемкость:
- мольную теплоемкость:
