А.а. барунин, д.с. маслобоев
А.А. БАРУНИН, Д.С. МАСЛОБОЕВ
ТЕРМОДИНАМИЧЕСКИЕ
РАСЧЕТЫ
Министерство образования и науки Российской Федерации
Балтийский государственный технический университет «Военмех»
А.А. БАРУНИН, Д.С. МАСЛОБОЕВ
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
Учебное пособие
Санкт-Петербург
УДК 541(075.8)
Б26
| Барунин, А.А. Термодинамические расчеты: учебное пособие / А.А. Барунин, Д.С. Маслобоев; Балт. гос. техн. ун-т. – СПб., 2016. – 24 с. ISBN 978-5-85546-923-3 Излагаются в упрощенной форме краткие теоретические сведения по одной из основных тем курса химии – «Химическая термодинамика», а также методы и примеры решения типовых задач по расчету термодинамических характеристик химических реакций. Предназначено для студентов технических специальностей, изучающих дисциплину «Химия». Может быть использовано студентами при подготовке к зачету или экзамену. |
| Б26 |
УДК 541(075.8)
Р е ц е н з е н т канд. хим. наук, начальник отдела физико-хими-ческих методов исследования АО «ЦНИИМ» В.Н. Разуваев
Утверждено
редакционно-издательским
советом университета
ISBN 978-5-85546-923-3© Авторы, 2016
© БГТУ, 2016
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Энергия
При рассмотрении закономерностей протекания химических процессов наиболее важными являются два типа закономерностей: энергетические и временные. Первые изучает химическая термодинамика, вторые – химическая кинетика.
Изначально термодинамика – это наука о «движении тепла». Она возникла в начале XIX века как теоретическая база создания тепловых машин (в основном паровых котлов), послуживших основой промышленной революции.
Термодинамическое описание химических процессов включает в себя решение двух задач:
1) изучение энергетических характеристик термодинамических систем;
2) возможность предсказать направление протекания самопроизвольных химических процессов и указать способы осуществления целенаправленных химических превращений.
Энергия – одно из основных физических понятий и потому не имеет исчерпывающего определения. Для наших целей примем, что энергия – это такая характеристика движения и взаимодействия тел, которая связана с их способностью совершать изменения в состоянии системы и внешней среды.
Видов энергии очень много: механическая, тепловая, электромагнитная, ядерная и т.д. Каждая из них может только видоизменяться, т.е. превращаться в другие виды энергии.
Термодинамическая система – это ограниченная область пространства, занятая ее элементами. Элементы системы (подсистемы) считаются однородными. Граница системы может быть и физической (стенки сосуда), и мысленной. Все, что вне системы, составляет окружающую среду.
Термодинамические системы бывают трех видов:
1) изолированные (нет обмена ни веществом, ни энергией с окружающей средой). Примеры – герметичный сосуд с газом с теплоизоляционной оболочкой, Вселенная в целом;
2) замкнутые (нет обмена веществом с окружающей средой). Пример – герметичный сосуд;
3) открытые (есть и энерго- и массообмен с окружающей средой). Примеры – костер, человек.
В химической термодинамике изучаются только изолированные и замкнутые системы.
Состояния систем характеризуются параметрами состояния(функциями процесса) и функциями состояния.
Параметры состояния системы – это свойства, однозначно характеризующие однородные части системы. Например, для идеального газа параметрами являются четыре свойства: давление р, объём V, температура T и количество молей ν. Любые три из них независимы. Это означает, что, задав произвольно любые три из четырех параметров, мы по уравнению состояния (в данном случае это будет уравнение состояния Клапейрона–Менделеева) найдем четвертый:
рV= ν RT.
Для более сложных систем могут появиться дополнительные параметры состояния, например химический состав.
Остановимся на параметре T. Это абсолютная температура в градусах Кельвина, которая всегда положительна. Она характеризует среднюю кинетическую энергию хаотического движения, приходящуюся на одну степень свободы частицы системы:
<E> =1/2 ikT,
где i – число степеней свободы, k – постоянная Больцмана, <E> – средняя кинетическая энергия хаотического движения; i=3 для одноатомных молекул (три направления свободного движения), i=5 для двухатомных (свободное движение плюс два вращения), i=6 для трехатомных и более (свободное движение плюс три вращения).
С точки зрения термодинамики температура – особый параметр. Она является индикатором направления передачи тепла: самопроизвольно тепло передается от более горячего тела к более холодному.
Существует понятие нулевого (или четвертого) закона термодинамики, который гласит: две системы, находящиеся в тепловом равновесии с третьей, находятся в равновесии и друг с другом. При этом все три системы характеризуются одинаковым значением определяющего это равенство параметра – температуры. Этот закон сформулировал Ральф Говард Фаулер в 1931 г.
Параметры термодинамической системы делятся на интенсивные и экстенсивные. Интенсивные параметры не зависят от количества вещества в системе (давление, температура, напряженность электрического поля и др.), а экстенсивные зависят (объем, масса, заряд и др.).
Параметры состояния связаны друг с другом функциональными зависимостями. Те из функций, которые не зависят от истории системы, т.е. от того, как она попала в данное состояние, называются функциями состояния. Они однозначно характеризуют это состояние.
В качестве примера приведём такую функцию состояния системы как внутренняя энергия U. К термодинамическому пониманию этой величины мы вернемся позже, пока же достаточно того, что мы знаем об энергии: в изолированных системах она сохраняется во времени.
Особую форму в термодинамике имеет время. Оно лишено такого качества, как длительность, и проявляется только как фиксация качественных изменений. В термодинамике рассматривается не ход процесса, а только его результат. Результатом же в классической термодинамике всегда является равновесное состояние системы и среды. Равновесное состояние характеризуется неизменностью параметров во времени. Термодинамический процесс – это переход системы из одного равновесного состояния в другое. Событие в термодинамике – это изменение равновесных параметров в ходе термодинамического процесса.
По разным признакам в термодинамике процессы классифицируются так:
1. По конечному результату – например, циклические,в результате которых параметры приобретают исходные значения.
2. По характеру взаимодействия с окружающей средой – обратимые и необратимые. Обратимые процессы не оставляют изменений в окружающей среде.
3. По местонахождению причины – самопроизвольные (причина в самой системе) и вынужденные (причина в окружающей среде).
4. При постоянстве какого-либо параметра процесса – изотермический (при постоянной температуре), изобарический, или изобарный (при постоянном давлении), изохорический, или изохорный (при постоянном объеме), адиабатический, или адиабатный (без обмена энергией с окружающей средой), самопроизвольный, несамопроизвольный, неравновесный, равновесный, обратимый, необратимый.
Термодинамика строится на трёх законах (постулатах, началах): первом, втором и третьем. Иногда говорят и о нулевом (или четвертом) законе термодинамики.
Тепловой эффект реакции
Тепловым эффектом химической реакции называется количество теплоты, выделяющейся в экзотермических процессах или поглощающейся в эндотермических процессах при осуществлении реакции при постоянном давлении или постоянном объёме и равенстве температур начального и конечного состояний системы.
Изучением тепловых эффектов реакций занимается термохимия. Наиболее распространенным является метод работы и расчётов при постоянном давлении.
В отличие от химической термодинамики в термохимии процессы рассматриваются с точки зрения окружающей среды, а потому знаки тепловых эффектов обратные: «+» для экзотермических и
«-» для эндотермических процессов. Иными словами,
Qх.р= - ∆ Hх.р (или Qr = - ∆Hr).
Индекс «х.р» – химическая реакция, «r» – reaction (реакция).
При записи стехиометрических уравнений в термохимии обязательно указывается агрегатное состояние реагентов и продуктов реакции, а также тепловой эффект:
2H2Oж + 2Naтв = 2NaOHр-р + H2г + Qх.р (- ∆Hх.р).
В термохимии введено важное понятие теплоты образованияхимического соединения: это удельный тепловой эффект реакции образования сложного химического соединения из чистых простыхвеществ, находящихся в равновесном состоянии при стандартных условиях. Удельный – значит приходящийся на 1 моль вещества. Стандартные условия давление 1,013∙105 Па (1 атм) и фиксированная температура (298,15 К).
Из определения следует, что теплота образования чистых простых веществ равна нулю. Например, для реакции Cграфит + O2г =
= CO2 + Qх.р,проведенной в стандартных условиях, Qх.р = Qобр. CO2.
В результате большого объёма экспериментальных исследований составлены таблицы теплот образования для огромного количества веществ. Они представлены в виде стандартных энтальпий образования, имеющих вид: ∆fH0298A, где индекс «f» означает formation (образование), индекс «0» – стандартное состояние, 298 – температуру,
A – вещество. Последний индекс часто опускают, вынося указание на формулу вещества в шапку таблицы.
Величина ∆fH0298 имеет размерность кДж/моль и относится к образованию одного моляданного вещества А.
Понятие энтропии
Чтобы это понять, рассмотрим ещё одну функцию состояния, которую ввел в термодинамику Р. Клаузиус (1850 г.) при анализе КПД тепловой машины.
Оказалось, что для обратимых тепловых процессов, протекающих при постоянной температуре, изменение некоторой величины S связано с количеством энергии, передаваемой в форме тепла ∆QT, следующим соотношением:
∆S = ∆QT /T.
Величина S является функцией состояния, поскольку, как оказалось, зависит только от природы и параметров системы T, р и V и не зависит от того, каким путем система приходит из начального состояние в конечное. Эта функция имеет размерность Дж/ К и называется энтропией.
В пределе соотношение, введенное Клаузиусом (и называемое формулой Клаузиуса) выглядит так:
dS = δ QT / T.
Формула Клаузиуса является определением термодинамической энтропии как функции состояния.
Энтропия – экстенсивная функция состояния, поэтому для удобства сравнения различных систем (а в химии системы различаются по составу) чаще используется удельная характеристика – энтропия одного моля вещества в системе, имеющая размерность Дж/(моль К).
Обратим внимание на то, что в правой части формулы Клаузиуса – строго фиксированная температура (температура – мера кинетической энергии частиц). А потому передаваемое здесь тепло не изменяет среднюю кинетическую энергию частиц в системе. Но что же тогда меняется?
Поскольку тепло – это та часть кинетической энергии частиц системы, которая связана исключительно с хаотическим движением,можно сказать, что понятие тепла выявляетособую качественную характеристику системы – её хаотичность, а энтропия – количественная мера хаотичности системы.
Осознание понятия термодинамической энтропии, количественно характеризующей хаос, утвердило и сам хаос как одно из объективных качеств окружающего нас физического мира,равнозначное таким его характеристикам, как энергия, масса, объем, давление.
К таким же выводам приводит и другой подход к определению энтропии, который развил Л. Больцман, исходя из вероятностного подхода к описанию термодинамических систем.
Больцман связал хаотичность с непредсказуемостью: чем более хаотична система, тем труднее предсказать ее конкретную структуру при заданном термодинамическом состоянии, т.е. при заданных параметрах. Например, для газов чрезвычайно сложно указать конкретные координаты и импульсы всех молекул в заданном объеме при определенных р, V, T. Он ввел и меру сложности предсказания – термодинамическую вероятность W.
Термодинамическая вероятность W – это число возможных микросостояний системы, которые обеспечивают параметры данного макросостояния.
Больцман показал, что такая, вероятностная, трактовка хаотичности связана с энтропией по Клаузиусу соотношением
S = k∙lnW,
где k – постоянная Больцмана (1,38∙10- 23Дж/К), W – термодинамическая вероятность данного состояния.
Рассмотрим такой вопрос: сколькими способами (взаимным расположением в пространстве и заданием энергетического состояния) можно реализовать систему, содержащую 1 моль газообразного водорода при давлении 1,013∙105 Па и температуре 298 К?
Энтропия моля водорода при этих (стандартных) условиях равна S0298 H2 = 130,59 Дж/(моль К).
Расчет по формуле Больцмана дает
W 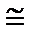 exp (10000000000000000000000000).
exp (10000000000000000000000000).
Таково число вариантов размещения в 22,4 литрах пространства 6,02∙1023 штук молекул водорода при стандартных условиях. Очевидно, что это «стандартное состояние» весьма хаотично!
Расчет изменения энтропии в конкретных процессах является хорошо разработанным разделом термодинамики. После введения понятия энтропии оказалось, что в термодинамических системах, помимо первого, существует и действует второй закон (второе начало) термодинамики.
Он имеет много формулировок, первую из которых дал Клаузиус (теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому), однако для нас будет важна следующая:
в изолированных системах самопроизвольно протекают только процессы, сопровождающиеся увеличением энтропии.
Математически это записывается как
dSad≥0 (здесь индекс ad – адиабатический процесс).
Равенство нулю dSad возможно при обратимом проведении циклических (равновесных) процессов.
Следует подчеркнуть, что действие второго начала термодинамики строго ограничено только изолированными системами. А вот понятие энтропии, которое породило этот закон, применимо ко всем видам термодинамических систем и играет важную роль в понимании хода всех термодинамических процессов. Вне рамок адиабатических процессов энтропия, по физическому смыслу представляющая хаос, если в системе ей не противостоит какая-то противодействующая причина, стремится к возрастанию.
В общем случае для любого процесса второй закон термодинамики можно представить в виде
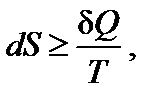
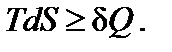
Знак равенства относится к равновесным процессам, знак неравенства – к неравновесным. Знак неравенства появляется потому, что работа, производимая системой в необратимом (неравновесном)
процессе, меньше работы, производимой в обратимом (равновес-
ном) процессе: Wнеравн< Wравн. Из первого начала термодинамики
(dU =dQ + dW) и с учетом того, что внутренняя энергия – функция состояния (dUравн = dUнеравн), следует: dQнеравн > dQравн. Тогда для необратимого (неравновесого) процесса изменение энтропии
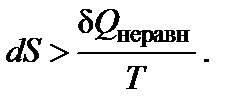
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Пример 1. Определить тепловой эффект процесса термического разложения хлорида аммония и составить термохимическое уравнение реакции.
Решение. Реакция выражается уравнением NH4Cl(к) → NH3(г) + + HCl(г). Согласно следствию из закона Гесса
∆H0298 (реакции) = ∑(n'∆fH0298)прод− ∑(n''∆fH0298)исх =
= ∆H0298(NH3)(г) + ∆H0298(HCl)(г) - ∆H0298(NH4Cl)(к).
Используя справочные данные значений ∆H0298веществ, получаем
∆H0298(реакции) = (-46,2 – 92,2) – (-314,2) = + 175 кДж.
Таким образом, термическое разложение NH4Cl является эндотермической реакцией. Термохимическое уравнение имеет вид
NH4Cl(к) → NH3(г) + HCl(г) - 175 кДж.
Пример 2. Тепловой эффект реакции С(т) + ½О2(г) = СО(г) при постоянном объеме и температуре 20º С равен 108,9 кДж. Определить тепловой эффект реакции при постоянном давлении.
Решение. Соотношение между тепловым эффектом при
V = const (QV =∆U) и тепловым эффектом при р = const (Qр =∆H) выражается уравнением ∆H = ∆U + р∆V. Определяем изменение числа молей газов в ходе реакции:
∆n = 1 - ½ = ½ (моль).
Учитывая значение Т = 293 К, R = 8,314 Дж/моль·К, а также единицы измерения величин, получаем для теплового эффекта реакции при р = const
∆H = ∆U + ∆n R T = - 108,9+1/2·8,314 /103·293 = - 107,68 кДж.
Пример 3. Возможен ли процесс получения металлического железа из оксида Fe2O3 действием водорода при стандартных условиях Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(ж)? Как скажется повышение температуры на вероятности протекания этой реакции?
Решение. Для ответа на первый вопрос задачи необходимо
рассчитать изменение свободной энергии Гиббса ∆G0298 для
рассматриваемой реакции, используя уравнение ∆GT(реакции) =
= ∆HT (реакции) − T∆SТ(реакции). Значения ∆H0298 и ∆S0298 для всех веществ, участвующих в реакции, приводятся в задании или берутся из таблиц термодинамических величин.
По следствию из закона Гесса ∆H0298(реакции) =
= ∑(n'∆fH0298)прод − ∑(n''∆fH0298)исх,найдем
∆H0298(реакции) = 3∆H0298 (H2O)(ж) – ∆H0298(Fe2O3)(к) = 3 (-285,8) – (-822,0)=
= - 857,4 + 822,0 = - 35,4 кДж.
Значение ∆H0298 (H2)(г) = 0 и ∆H0298 (Fe)(к) = 0.
Согласно
∆S0298(реакции)= ∑(n'S0298)прод − ∑(n''S0298)исх,
найдем
∆S0298(реакц) =[3S0298(H2O)(ж) + 2S0298(Fe)(к)] - [S0298 (Fe2O3)(к) +
+ 3S0298(H2)(г)] = (3·70,1 + 2·2,27) - (87,0 + 3·130,5) = - 213,8 Дж/К.
По найденным данным вычисляем
∆G0298 = ∆H0298 − T∆S0298 = - 35,4 + 213,8·10-3·298 = 28,34 кДж.
Положительное значение ∆G указывает на невозможность восстановления Fe2O3 водородом при стандартных условиях.
Ответ на второй вопрос задачи определяется знаком ∆S. Рас-
чет показал, что ∆S0298реакции < 0, следовательно, в уравнении ∆G = ∆H − T∆S величина −T∆S > 0. Повышение температуры приводит к увеличению значения ∆G, а значит, не будет способствовать протеканию реакции в прямом направлении.
Пример 4. Определить стандартный тепловой эффект реакции, если известны теплоты образования веществ.
1. Реакция образования сульфата алюминия из оксида алюминия и триоксида серы:
Al2O3 (кр) + 3SO3 (газ) = Al2(SO4)3 (кр).
| Вещество | Al2O3 (кр) | SO3 (газ) | Al2(SO4)3 (кр) |
| DfН0298, кДж/моль | –1676,1 | –395,9 | –3442,8 |
Решение. Тепловой эффект реакции определяем по первому следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298=(1×DfН0Al2(SO4)3)–(1×DfН0Al2O3 + 3×DfН0SO3 ) =
=1 (–3442,8) – [1 (–1676,1) + 3(–395,9)] = –579 [кДж].
2. Реакция взаимодействия метана и диоксида углерода с образованием оксида углерода и водорода:
CH4 (газ) + CO2 (газ) = 2 CO (газ) + 2H2 (газ).
| Вещество | CH4 (газ) | CO2 (газ) | CO (газ) | H2 (газ) |
| DfН0298, кДж/моль | –74,85 | –393,51 | –110,5 |
Решение. Тепловой эффект реакции определяем по следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298=(2×DfН0CO + 2×DfН0H2)–(1 DfН0CH4 + 1 DfН0CO2) =
=[2 (–110,5) + 2×0] – [1 (–74,85) + 1 (–393,51)] = 247,36 [кДж].
Пример 5. Определить стандартный тепловой эффект реакции, если известны стандартные теплоты сгорания веществ. Реакция взаимодействия уксусной кислоты и этилового спирта с образованием сложного эфира – этилацетата:
CH3COOH(ж) + C2H5OH(ж) = CH3COOC2H5(ж) + H2О(ж).
| Вещество | CH3COOH(ж) | C2H5OH(ж) | CH3COOC2H5(ж) | H2О(ж) |
| DcН0298, кДж/моль | –873,79 | –1366,91 | –2254,21 |
Решение. Тепловой эффект реакции определяем по следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298 =(1 DcН0ук + 1 DcН0эс)–(1 DcН0эа + 1 DcН0H2O) =
= [1 (–873,79) +1 (–1366,91)] – [1 (–2254,21)+ 1×0] = 13,51[кДж].
Пример 6. Определить изменение энтропии в стандартных условиях при протекании реакции:
CH4 (газ) + CO2 (газ) = 2CO (газ) + 2H2 (газ).
| Вещество | CH4 (газ) | CO2 (газ) | CO (газ) | 2H2 (газ) |
| S0298, Дж/моль×К | 186,27 | 213,66 | 197,55 | 130,52 |
Решение. Dr S0298=(åni S0298i)продукты–(åni iS0298i)исх. вещества,
Dr S0298 = (2×197,55 + 2×130,52) – (1×186,27 + 1×213,66) = 256,21 [Дж/K].
Пример 7.Определить направление самопроизвольного протекания реакции взаимодействия оксида кальция и воды с образованием дигидроксида кальция в стандартных условиях:
CaO(кр) + H2O(ж) = Ca(OH)2(кр).
| Вещество | CaO(кр) | H2O(ж) | Ca(OH)2(кр) |
| DfG0298, кДж/моль | –603,46 | –237,23 | –897,52 |
| DfH0298, кДж/моль | –635,09 | –285,83 | –985,12 |
| S0298, Дж/моль×К | 38,07 | 69,95 | 83,39 |
Решение. Направление самопроизвольного протекания реакции определяется по изменению энергии Гиббса (DrG0 < 0).
1. Зная величины DfG0 для реагентов, можно непосредственно вычислить изменение энергии Гиббса в ходе реакции:
Dr G0298 = (å ni DfG0i)прод – (å ni DfG0i)исх. вещества,
Dr G0298 = (1(–897,52)) – [1(–603,46) + 1(–237,23)] = –56,83 (кДж).
Следовательно, данная реакция в стандартных условиях может самопроизвольно протекать в прямом направлении.
2. Изменение энергии Гиббса можно также вычислить по тепловому эффекту и энтропии реакции:
Dr G0298 = Dr Н0298 –298 Dr S 0298,
Dr Н0298 = (å ni DfН0298i)прод – (å ni DfН0298i)исх. вещества,
Dr S0298 = (åni S0298i)прод – (åni S0298i) исх. вещества,
Dr Н0298 = (1(–985,12)) – (1(–635,09) + 1(–285,83)) = –64,2 (кДж),
Dr S0298 = (1×83,39) – (1×38,07 + 1×69,95) = –24,63 (Дж/K),
Dr G0298 = –64,2 – 298(–24,63×10-3) = –56,86 (кДж).
Результаты первого и второго расчетов, естественно, совпадают (с учетом погрешности).
Пример 8. Определить возможность самопроизвольного окисления ртути кислородом в стандартных условиях (прямая реакция) и температуру, при которой возможен самопроизвольный распад окиси ртути на ртуть и кислород (обратная реакция):
Hg(ж) + ½ O2(газ) = HgO(кр).
| Вещество | Hg(ж) | O2(газ) | HgO(кр) |
| DfH0298, кДж/моль | –90,88 | ||
| S0298, Дж/моль×К | 75,90 | 205,04 | 70,29 |
Решение. Изменение энергии Гиббса в ходе реакции вычисляют по тепловому эффекту и энтропии реакции при Т=298 К:
Dr G0(Т) » Dr Н0298 – Т Dr S0298,
Dr Н0298 = (å ni DfН0298i)прод – (å ni DfН0298i)исх. вещества,
Dr S0298 = (åni S0298i)прод – (åni S0298i) исх. вещества,
Dr Н0298 = 1(–90,88) – (1×0 +½×0) = –90,88 кДж/моль,
Dr S0298 = 1×70,29 – (1×75,90 +½×205,04) = –108,13 Дж/моль×K,
Dr G0298 = –90,88 – 298(–108,13×10-3) = –58,65 кДж/моль.
Поскольку DrG0298 < 0, то окисление ртути в стандартных условиях возможно.
Самопроизвольное разложение окиси ртути на кислород и ртуть возможно, если для обратной реакции 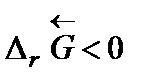 . Поскольку
. Поскольку 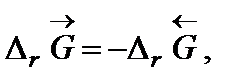 то обратная реакция по отношению к окислению возможна, если DrG0(Т) » Dr Н0 – Т Dr S 0 > 0, что выполняется при температуре выше
то обратная реакция по отношению к окислению возможна, если DrG0(Т) » Dr Н0 – Т Dr S 0 > 0, что выполняется при температуре выше 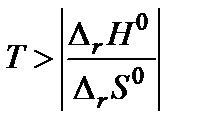 = 840,47 К.
= 840,47 К.
Библиографический список
1. Коровин, Н.В. Общая химия. М.: Высшая школа, 2000.
2. Стромберг, А.Г., Семченко Д.П. Физическая химия / Под ред. А.Г. Стромберга. М.: Высшая школа, 2001.
3. Фримантл, М. Химия в действии: В 2 ч. / Пер. с англ. М.: Мир, 1991.
4. Киселев, А.П., Крашенинников А.А. Основы общей химии: учебное
пособие / Балт. гос. техн. ун-т. СПб., 2012.
5. Кудряшов, И.В., Каретников Г.С. Сборник примеров и задач по физической химии: учебное пособие. М.: Высшая школа, 1991.
О Г Л А В Л Е Н И Е
1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.. 3
1.1. Энергия. 3
2. ПЕРВЫЙ ЗАКОН (НАЧАЛО) ТЕРМОДИНАМИКИ.. 6
2.1. Термодинамическая функция энтальпия. 7
2.2. Тепловой эффект реакции. 8
2.3. Закон Гесса. Термохимические расчеты.. 9
2.4. Зависимость теплового эффекта реакции от температуры.. 10
3. ВТОРОЙ ЗАКОН (НАЧАЛО) ТЕРМОДИНАМИКИ.. 11
3.1. Понятие энтропии. 12
3.2. Изменение энтропии в некоторых процессах. 14
3.3. Направленность самопроизвольных процессов. Свободная энергия Гиббса 16
4. ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ.. 19
Библиографический список. 23
Барунин Анатолий Анатольевич, Маслобоев Дмитрий Степанович
Термодинамические расчеты
Редактор Г.М. Звягина
Корректор Л.А. Петрова
Подписано в печать 19.02.2016. Формат 60х84/16. Бумага документная.
Печать трафаретная. Усл. печ. л. 1,5. Тираж 200 экз. Заказ № 45.
Балтийский государственный технический университет
Типография БГТУ
190005, С.-Петербург, 1-я Красноармейская ул., д.1
А.А. БАРУНИН, Д.С. МАСЛОБОЕВ
ТЕРМОДИНАМИЧЕСКИЕ
РАСЧЕТЫ
Министерство образования и науки Российской Федерации
Балтийский государственный технический университет «Военмех»
А.А. БАРУНИН, Д.С. МАСЛОБОЕВ
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
Учебное пособие
Санкт-Петербург
УДК 541(075.8)
Б26
| Барунин, А.А. Термодинамические расчеты: учебное пособие / А.А. Барунин, Д.С. Маслобоев; Балт. гос. техн. ун-т. – СПб., 2016. – 24 с. ISBN 978-5-85546-923-3 Излагаются в упрощенной форме краткие теоретические сведения по одной из основных тем курса химии – «Химическая термодинамика», а также методы и примеры решения типовых задач по расчету термодинамических характеристик химических реакций. Предназначено для студентов технических специальностей, изучающих дисциплину «Химия». Может быть использовано студентами при подготовке к зачету или экзамену. |
| Б26 |
УДК 541(075.8)
Р е ц е н з е н т канд. хим. наук, начальник отдела физико-хими-ческих методов исследования АО «ЦНИИМ» В.Н. Разуваев
Утверждено
редакционно-издательским
советом университета
ISBN 978-5-85546-923-3© Авторы, 2016
© БГТУ, 2016
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Энергия
При рассмотрении закономерностей протекания химических процессов наиболее важными являются два типа закономерностей: энергетические и временные. Первые изучает химическая термодинамика, вторые – химическая кинетика.
Изначально термодинамика – это наука о «движении тепла». Она возникла в начале XIX века как теоретическая база создания тепловых машин (в основном паровых котлов), послуживших основой промышленной революции.
Термодинамическое описание химических процессов включает в себя решение двух задач:
1) изучение энергетических характеристик термодинамических систем;
2) возможность предсказать направление протекания самопроизвольных химических процессов и указать способы осуществления целенаправленных химических превращений.
Энергия – одно из основных физических понятий и потому не имеет исчерпывающего определения. Для наших целей примем, что энергия – это такая характеристика движения и взаимодействия тел, которая связана с их способностью совершать изменения в состоянии системы и внешней среды.
Видов энергии очень много: механическая, тепловая, электромагнитная, ядерная и т.д. Каждая из них может только видоизменяться, т.е. превращаться в другие виды энергии.
Термодинамическая система – это ограниченная область пространства, занятая ее элементами. Элементы системы (подсистемы) считаются однородными. Граница системы может быть и физической (стенки сосуда), и мысленной. Все, что вне системы, составляет окружающую среду.
Термодинамические системы бывают трех видов:
1) изолированные (нет обмена ни веществом, ни энергией с окружающей средой). Примеры – герметичный сосуд с газом с теплоизоляционной оболочкой, Вселенная в целом;
2) замкнутые (нет обмена веществом с окружающей средой). Пример – герметичный сосуд;
3) открытые (есть и энерго- и массообмен с окружающей средой). Примеры – костер, человек.
В химической термодинамике изучаются только изолированные и замкнутые системы.
Состояния систем характеризуются параметрами состояния(функциями процесса) и функциями состояния.
Параметры состояния системы – это свойства, однозначно характеризующие однородные части системы. Например, для идеального газа параметрами являются четыре свойства: давление р, объём V, температура T и количество молей ν. Любые три из них независимы. Это означает, что, задав произвольно любые три из четырех параметров, мы по уравнению состояния (в данном случае это будет уравнение состояния Клапейрона–Менделеева) найдем четвертый:
рV= ν RT.
Для более сложных систем могут появиться дополнительные параметры состояния, например химический состав.
Остановимся на параметре T. Это абсолютная температура в градусах Кельвина, которая всегда положительна. Она характеризует среднюю кинетическую энергию хаотического движения, приходящуюся на одну степень свободы частицы системы:
<E> =1/2 ikT,
где i – число степеней свободы, k – постоянная Больцмана, <E> – средняя кинетическая энергия хаотического движения; i=3 для одноатомных молекул (три направления свободного движения), i=5 для двухатомных (свободное движение плюс два вращения), i=6 для трехатомных и более (свободное движение плюс три вращения).
С точки зрения термодинамики температура – особый параметр. Она является индикатором направления передачи тепла: самопроизвольно тепло передается от более горячего тела к более холодному.
Существует понятие нулевого (или четвертого) закона термодинамики, который гласит: две системы, находящиеся в тепловом равновесии с третьей, находятся в равновесии и друг с другом. При этом все три системы характеризуются одинаковым значением определяющего это равенство параметра – температуры. Этот закон сформулировал Ральф Говард Фаулер в 1931 г.
Параметры термодинамической системы делятся на интенсивные и экстенсивные. Интенсивные параметры не зависят от количества вещества в системе (давление, температура, напряженность электрического поля и др.), а экстенсивные зависят (объем, масса, заряд и др.).
Параметры состояния связаны друг с другом функциональными зависимостями. Те из функций, которые не зависят от истории системы, т.е. от того, как она попала в данное состояние, называются функциями состояния. Они однозначно характеризуют это состояние.
В качестве примера приведём такую функцию состояния системы как внутренняя энергия U. К термодинамическому пониманию этой величины мы вернемся позже, пока же достаточно того, что мы знаем об энергии: в изолированных системах она сохраняется во времени.
Особую форму в термодинамике имеет время. Оно лишено такого качества, как длительность, и проявляется только как фиксация качественных изменений. В
