Результаты измерений и расчетов опыта III
| № опыта | Vщ, 10−3 л | Cк, моль/л | Vкi, 10−3 л | Vк, 10−3 л средний | Cщ, моль/л | ωщ |
| 0,1 | Vк1 = | Vк = (Vк1 + Vк2 + + Vк3)/3 | Cщ = Vщ∙ Cщ/Vщ | ωщ = Cщ ∙ Мщ ∙ 10−3 | ||
| 0,1 | Vк2 = | |||||
| 0,1 | Vк3 = |
Рассчитать Vк – средний объем раствора кислоты, израсходованный на реакцию нейтрализации 8 мл раствора щелочи в трех опытах:
Vк = (Vк1 + Vк2 + Vк3)/3.
Рассчитать концентрацию раствора щелочи Cщ, используя соотношение Vк ∙ Cк = Vщ ∙ Cщ, поскольку один моль щелочи вступает в реакцию нейтрализации с одним молем кислоты:
Cщ = Vк ∙ Cк/Vщ [моль/л].
Рассчитать массовую долю щелочи ωщ (отношение массы растворенного вещества к общей массе раствора), приняв плотность раствора щелочи r » 1 г/см3:
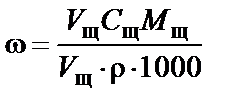 ,
,
ωщ = Cщ ∙ Мщ ∙ 10−3,
где Cщ – концентрация раствора щелочи [моль/л]; Мщ – молярная масса щелочи [г/моль], V – объем [1000 см3] – 1 л раствора щелочи, r – плотность раствора NaOH [г/см3].
Отчет должен содержать реакцию титрования (здесь нейтрализации), используемый индикатор, заполненную таблицу, значения величин в формулах при расчете Vк, Cщ и ωщ.
Вывод: что позволяет определить метод объемного титрования?
Вариант 2
Опыт I. Получение нерастворимого гидроксида металла, исследование его кислотно-основных свойств (уравнения реакций писать в молекулярной и сокращенной ионной форме)
I.А. Получение гидроксида Cr(OH)3 по обменной реакции раствора соли, содержащего катион металла Men+, и раствора щелочи, содержащего гидроксо-анион OH–.
Для получения гидроксида Cr(OH)3 поместить в две пробирки 1−2 мл раствора соли CrCl3, содержащий ион металла Cr3+ и по каплям добавить раствор щелочи NaOH (ω = 10%) до образования осадка одного и того же гидроксида Cr(OH)3 в обеих пробирках. Написать уравнение реакций в молекулярной и сокращенной ионной форме:
CrCl3 + NaOH ® …..;
Cr3+ + 3OH− ® ….. ¯
Исследование кислотно-основных свойств полученного гидроксида (кислотные свойства – возможность реагировать с основанием – вступать в реакцию нейтрализации в качестве кислоты; основные свойства – возможность реагировать с кислотой – вступать в реакцию нейтрализации в качестве основания; амфотерные свойства – вступать в реакцию нейтрализации, как в качестве основания, так и в качестве кислоты).
Для этого в одну пробирку, содержащую Cr(OH)3, добавить раствор концентрированной щелочи NaOH (ω = 30%), а во вторую пробирку, также содержащую Cr(OH)3, добавить раствор разбавленной кислоты HCl (ω = 10%). Растворение осадков свидетельствует о протекании реакции нейтрализации (не растворение – отсутствие взаимодействия). Написать уравнения реакций в молекулярной и сокращенной ионной форме:
Cr(OH)3 + Na(OH) ® …..;
Cr(OH)3 + OH– ® …..
Cr(OH)3 + HCl ® …..;
Cr(OH)3 + H+ ® …..
I.Б. Таким же образом получить гидроксид Ni(OH)2 из раствора соли NiSO4.
Исследовать его кислотно-основные свойства (использовать при взаимодействии осадка Ni(OH)2 c разбавленной кислотой – H2SO4). Написать уравнения всех реакций. Сделать выводы.
NiSO4 + NaOH ® …..;
Ni2+ + 2OH– ® Ni(OH)2¯;
Ni(OH)2 + OH– ®
Ni(OH)2 + H+ ®
Вывод: какой из двух гидроксидов проявляет основные, а какой амфотерные свойства?
Опыт II. Окислительно-восстановительные реакции
Чтобы правильно составить окислительно-восстановительные реакции А и Б, необходимо подобрать коэффициенты методом электронно-ионного баланса:
II.А. Окисление нитрит иона (NO2–) дихромат ионом (Cr2O72–) в кислой среде (H+).
Поместить в пробирку 0,5 мл раствора дихромата калия К2Cr2O7 добавить 1−2 мл разбавленной H2SO4, добавить 1−2 мл раствора нитрита калия КNO2, нагреть на песчаной бане.
Изменение цвета раствора свидетельствует о протекании реакции
K2Cr2O7 + КNO2 + H2SO4 ® КNO3 + Сr2(SO4)3 + K2SO4 +...
Ионы Cr3+ в водном растворе имеют зелено-фиолетовую окраску, ионы NO3–бесцветны.
II.Б. Растворить металлическую медь в концентрированной азотной кислоте.
Поместить в пробирку кусочек металлической меди добавить
1−2 мл концентрированной HNO3.
Cu + HNO3 ® Cu(NO3)2 + NO2+ …
Ионы Cu2+ в водном растворе имеют голубую окраску, NO2 – газ бурого цвета
Вывод: какое вещество является окислителем? Какое вещество является восстановителем?
Опыт III. Титрование
В основе опыта III лежит реакция нейтрализации:
NaOH + HCl = NaCl + H2O.
Для проведения опыта при помощи бюретки отобрать 7 мл раствора NaOH (Vщ = 7 мл), поместить его в коническую колбу, добавить 2−3 капли раствора индикатора(метилоранж) и титровать раствором HCl (Cк = 0,1 моль/л) до изменения цвета индикатора с желтого на розовый при добавлении последней капли кислоты. Записать в таблицу объем раствора кислоты (Vкi) израсходованный на реакцию нейтрализации. Опыт повторить три раза. Результаты измерений и расчетов занести в таблицу.
