II. Основные законы термодинамики.
Первое начало термодинамики.
Первое начало говорит о возможности протекания процесса.
Теплота Q, подведенная к системе, идет на изменение внутренней энергии системы ΔU и совершение системой работы A.
Q = ΔU + A (1)
Первое начало в дифференциальной форме:
δQ = dU +δ A (2)
δQ, δA –зависят от вида процесса и не являются полными дифференциалами;
dU – зависит только от начального и конечного состояния и является полным дифференциалом.
Q>0 и δQ>0, если теплота подводится к системе, А >0, если работа совершается самой системой.
Второе начало термодинамики.
Второе начало термодинамики указывает направление процесса.
Качественные формулировки второго начала термодинамики:
- по Клаузиусу - «Невозможен процесс, единственным результатом которого была бы передача тепла от тела менее нагретого к более нагретому»;
- по Томсону -«Невозможен процесс, единственным результатом которого было бы совершение работы только за счет охлаждения одного тела».
Количественная формулировка второго начала термодинамики.
Существует такая функция состояния S – энтропия, элементарное изменение которой dS ≥ δQ/T (3).Знак« = »соответствует обратимым процессам, знак « > » соответствует необратимым процессам.
Обратимые процессы – такие, которые можно провести в прямом, а за тем и в обратном направлениях так, что после этого ни в системе, ни в окружающей среде не останется никаких изменений.
При необратимых процессах остаются изменения, которые нельзя скомпенсировать.
В изолированной системе δQ=0 и dS ≥0.Следовательно, энтропия остается постоянной (dS=0)при обратимых процессах и возрастает (dS>0) при необратимых процессах.
Энергия связи Wсвяз зависит от степени неупорядоченности молекулярного движения, а ее количественной мерой является температура Т. Степень неупорядоченности зависит также и от свойств самой системы, которые Клаузиус охарактеризовал коэффициентом пропорциональности S, названный энтропией.
Wсвяз =sT (4) => s= Wсвяз/T (5)
Термодинамический смысл энтропии.
Энтропия – мера обесценивания энергии при необратимых процессах. В изолированной системе все процессы идут в направлении исчезновения градиентов (температуры, давления, потенциалов, концентрации) – градиентные процессы. Противоградиентные процессы – сопровождаются уменьшением энтропии, следовательно, не могут идти в изолированных системах.
Энтропия – физическая величина, характеризующая меру связанной энергии системы, приходящейся на единицу температуры (1 К).
Энтропия – функция состояния системы, поскольку целиком определяется параметрами системы и не зависит от того, как система пришла в данное состояние.
Изменение энтропии при элементарном обратимом процессе определяется выражением
ds =dQ/T (6)
При обратимом переходе из состояния (1) в состояние (2)
Δs= 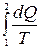 Q (7)
Q (7)
Для нахождения изменения энтропии при необратимом процессе, нужно рассмотреть какой либо обратимый процесс, приводящий систему в то же конечное состояние, и вычислить для этого процесса изменение энтропии.
Статистический смысл энтропии.
Энтропия – мера беспорядка в системе. По Больцману s=k ln Pтд (8), где k – постоянная Больцмана. Pтд – термодинамическая вероятность (число возможных микросостояний, которыми может быть реализовано данное макросостояние).
Второе начало термодинамики – это алгоритм, который дает возможность достоверно предсказать направление процессов в любом случае. Оно формулируется в следующем виде «при переходе из одного состояния в другое наиболее вероятным изменением энтропии является ее возрастание». Однако при флуктуациях протекают процессы, которые сопровождаются уменьшением энтропии, но эти малые отклонения от равновесного состояния не противоречат второму закону. Они являются неизбежным следствием именно вероятностного характера энтропии.
Термодинамические функции.
Внутренняя энергия U это совокупность свободной энергии G и связанной энергии Wсвяз элементов системы:
U = G + Wсвяз (9) или U = G +s T (10)
При изобарических процессах при постоянной температуре cвободная энергии G называют свободной энергией Гельмгольца и обозначается
буквой F. F = U – s •T (11)
При постоянной температуре и изменяющемся объеме свободная энергия имеет более сложный вид:
G = U – s T + pV (12)
В этом случае свободную энергию называют свободной энергией (G)Гиббса.
Практический интерес представляет не сама свободная энергия, а ее изменение. При V = const и T= const
ΔF = ΔU – T Δs (13)
При изменяющемся объеме (T= const)
ΔG = ΔU – T Δs + p ΔV (14)
Из полной энергии системы выделяют величину Н (функцию состояния) названную энтальпией.
Н = U + pV (15)
При постоянном давлении изменение энтальпии равно количеству тепла, полученного системой: dH = dQ. Поэтому энтальпию иногда называют теплосодержанием.
Свободная энергия Гиббса
G = U – s T + pV = Н – s T (16)
При постоянном давлении и температуре механическая работа имеет максимальное значение равное изменению энергии Гиббса АрТ = - ΔG
При Р = const и T= const процессы в системе идут в направлении, когда ΔG = ΔU – T Δs + p ΔV<0 (17)
4.Применение первого начала термодинамики в биологии.
Первое начало термодинамики было сформулировано (врачами Майером и Гельмгольцем) для живых организмов. Однако классическая форма (уравнение 1) не вполне отображает сути термодинамических процессов происходящих в биологических системах. Поэтому уравнение первого начала удобнее записать в следующем виде:
ΔU = Wпищ - Q - A (18)
Где Wпищ - химическая энергия пищевых продуктов, усвоенных организмом, знак «-» означает, что биосистема отдает тепло окружающей среде.
Организм гомойотермных (постоянной температурой) животных имеет в среднем постоянную температуру и постоянный химический состав. Поэтому изменение внутренней энергии ΔU = 0. В этом случае
Wпищ = Q + A
Учитывая разные формы совершения работы и теплообмена
Wпищ = ∑Qi + ∑Aj (19)
Первичным источником энергии для тепловых машин и живого организма служит Солнце. Однако способы преобразования в работу солнечной энергии, аккумулированной зелеными растениями в форме химической энергии, принципиально неодинаковы в тепловой машине и биологической системе.
Для тепловых машин:
фотосинтез сжигание (О2; Т)
Wсолн --------------->Wтопл -----------------> Q ---> ΔU+ A.
Для биологической системы:
фотосинтез биологическое окисление (О2)
Wсолн ---------------> Wтопл ---------------------------------> ΔU+ A + Q
Источником свободной энергии для всех организмов является пища. Пищеварение обеспечивает поступление в клетки продуктов гидролиза углеводов, жиров, белков, в которых заключена свободная энергия солнечного света.
Основным способом использования свободной энергии питательных веществ организмом является биологическое окисление на внутренних мембранах митохондрий. При этом часть энергии идет непосредственно для осуществления жизнедеятельности, а основная часть идет на синтез макроэргических соединений (АТФ и др.).
Другая часть свободной энергии идет на поддержание физико-химических градиентов на клеточных мембранах.
Еще часть свободной энергии идет на работу мышечного сокращения (механическую работу организма).
Параллельно с совершением работы организм преобразует свободную энергию пищи в тепло. Во первых - тепло выделяется при биологическом окислении питательных веществ, в ходе которого синтезируется АТФ (первичное тепло Q1= 900ккал/сутки). Вторичное тепло Q2 = 900 ккал/сут выделяется при синтезе макромолекул (415 ккал/сут), активном транспорте веществ через мембраны (215 ккал/сутки), мышечных сокращениях(270 ккал/сутки). Суммарное значение тепловой энергии М, образующуюся в результате многообразных процессов, называют теплопродукцией М = ∑ Qі
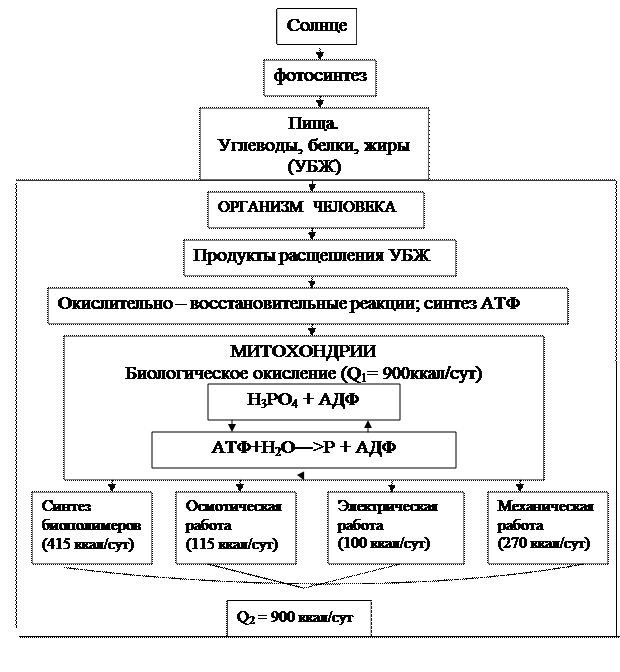
Вся тепловая энергия уходит с поверхности тела человека путем теплопроводности, конвекции, теплоизлучения (радиации), испарения
Путем теплопроводности теряется
QT= K(Ti –Te)St/ℓ (20).
К – коэффициент теплопроводности;
(Ti –Te) – разность температур поверхности тела Ti и окружающей среды Te;
ℓ - толщина слоя материала, через который переносится тепло;
S – площадь соприкосновения тела с окружающей средой;
t – время теплообмена.
Конвекционным путем переносится
Qс= K(Ti –Te)St/ℓ (21).
Коэффициент К не имеет постоянного значения и зависит от конкретных условий.
Перенос тепла излучением осуществляется инфракрасным излучением. QR = σ S (Ti4 –Te4) (22).
Путем испарения теряется
QE = L m (23)
L – удельная теплота испарения;
m – масса жидкости, испаряющейся с поверхности тела
Уравнение теплового баланса организма человека:
М ± QT ± Qс ± QR - QE = О (24)
Знак «-» при Ti >Te и знак «+» при Ti <Te.
Под химической терморегуляцией понимают возможность усиления или ослабления теплопродукции за счет изменения интенсивности окислительных процессов.
Физическая терморегуляция – регуляция процессов теплоотдачи (теплопроводности, конвекции, излучения, испарения)
Прямая калориметрия – определение энергозатрат организма с помощью специальных физиологических калориметров, в которые на определенное время помещают животное или человека.
Непрямая калориметрия – определение энергозатрат путем исследования газообмена организма.
Эффективность основных биологических процессов (Эф) определяется отношением увеличения свободной энергии (ΔG) биологической системы к уменьшению энтальпии (ΔН) при окислении пищи:
Эф = ΔG/ ΔН (25)
Эффективность показывает, какая часть энергии, выделяющаяся при химических реакциях, идет на увеличение свободной энергии биологической системы.
