Молекулярная физика. Первое начало термодинамики. Работа, совершаемая газом.
Билет№3
Уравне́ние состоя́ния —уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа.
P=nkT
P(V-νb)= νRT ---уравнение состояния газа с учетом конечного размера молекул
P+Pi=nkTили (P+ 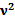 a/
a/ 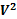 )V=Νrt ---с учетом внутеннего давления
)V=Νrt ---с учетом внутеннего давления
Piне зависит от материала стенки, в противном случае удалось бы создать вечный двигатель первого рода
(P+ 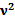 a/
a/ 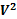 ) (V-νb)= νRT---данное уравнение справедливо при условии νb<<V,
) (V-νb)= νRT---данное уравнение справедливо при условии νb<<V, 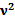 a/
a/ 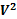 <<P
<<P
Температу́ра — физическая величина, характеризующая термодинамическую систему и количественно выражающая интуитивное понятие о различной степени нагретости тел. Температура - физическая величина, характеризующая среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия. В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Абсолютная температура это температура, измеряемая в Кельвинах
T=t+273(K)
Внутренняя энергия идеального газа — в идеальных газах внутренняя энергия определяется как сумма кинетических энергий молекул. Между молекулами идеального газа отсутствуют силы притяжения и потенциальная энергия взаимодействия равна нулю. Это означает, что внутренняя энергия идеального газа рассматривается как сумма всех кинетических энергий молекул.
Внутренняя энергия U равна сумме свободной и связанной энергии(TS)
U=F+TS
Свободная энергия – максимальная возможная работа, которую может совершить система, обладая каким-то запасом внутренней энергии.
Связанная энергия – это та часть внутр. энергии, которая не может быть переведена в работу это бесценная часть внутренней энергии.
Теплоёмкость идеального газа — отношение количества теплоты, сообщённого газу к изменению температуры , которое при этом произошло
Молярная теплоёмкость — теплоёмкость 1 моля идеального газа.
δQ=νC∆T
Cm=(1/ ν) (δQ/∆T)
Адиабатический
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть dQ=0. Однако, объём, давление и температура меняются, то есть dT≠0.
Следовательно, теплоёмкость идеального газа в адиабатическом процессе равна нулю: C=0/dT=0;
Изотермический
В изотермическом процессе постоянна температура, то есть dT=0 . При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна плюс-минус бесконечности:C→-∞;
Изохорный
В изохорном процессе постоянен объём, то есть dV=0.
Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (δA-δVP).
Первое Начало Термодинамики для изохорного процесса имеет вид:
dU=δQ=ν 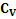 ∆T;
∆T;
А для идеального газа
dU=(i/2) νR∆T;
Таким образом,
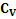 =(i/2)R;
=(i/2)R;
Где i— число степеней свободы частиц газа.
Другая формула:
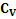 =R/(γ-1)
=R/(γ-1)
Где γ — показатель адиабаты, R — универсальная газовая постоянная.
Изобарный
Молярная теплоёмкость при постоянном давлении обозначается как 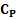 . В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера
. В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера
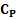 =
= 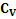 +R
+R
Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной:
для одноатомных газов 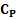 =5/2R то есть около 20.8 Дж/(моль·К);
=5/2R то есть около 20.8 Дж/(моль·К);
для двухатомных газов 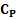 =7/2R то есть около 29.1 Дж/(моль·К);
=7/2R то есть около 29.1 Дж/(моль·К);
для многоатомных газов 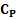 =4Rто есть около 33.3 Дж/(моль·К).
=4Rто есть около 33.3 Дж/(моль·К).
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Вопрос
Билет 7
Билет 9
Числом степени свободы называется число независимых переменных, определяющих ,положение тела в пространстве и обозначается i 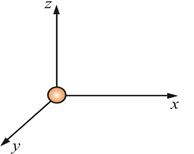 положение материальной точки (одноатомной молекулы) задаётся тремя координатами, поэтому она имеет три степени свободы: i = 3
положение материальной точки (одноатомной молекулы) задаётся тремя координатами, поэтому она имеет три степени свободы: i = 3
Закон о равномерном распределении энергии по
степеням свободы
средняя энергия приходящаяся на одну степень свободы: 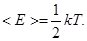
На среднюю кинетическую энергию молекулы, имеющей i-степеней свободы приходится 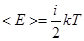
Круговой процесс
Круговым процессом, или циклом, называется такой процесс, в результате которого термодинамическое тело возвращается в исходное состояние.
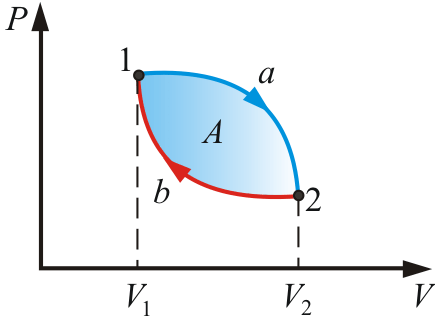
В диаграммах состояния P, V и других круговые процессы изображается в виде замкнутых кривых. Это связано с тем, что в любой диаграмме два тождественных состояния (начало и конец кругового процесса) изображаются одной и той же точкой на плоскости.
Цикл, совершаемый идеальным газом, можно разбить на процессы:
Расширения (1 – 2)
сжатия (2 – 1) газа
Работа расширения (1a2V2V11) -
положительна (dV >0)
Работа сжатия (2b1V1V22) -
отрицательна (dV < 0).
Работа, совершаемая за цикл, определяется площадью, охватываемой кривой
Если за цикл совершается положительная работа
(цикл протекает по часовой стрелке), то он называется прямым
Если за цикл совершается отрицательная работа
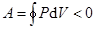
(цикл протекает против часовой стрелки), то он называется обратным.
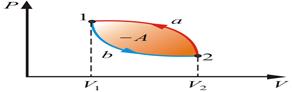
Рис. 1 Прямой цикл Рис. 2 Обратный цикл
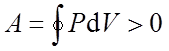
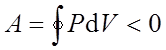
Круговые процессы лежат в основе всех тепловых машин: двигателей внутреннего сгорания, паровых и газовых турбин, паровых и холодильных машин и т. д.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю: dU = 0
Тогда первое начало термодинамики для кругового процесса
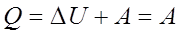
Если 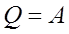 т.о. работа, совершаемая за цикл, равна количеству полученной извне теплоты.
т.о. работа, совершаемая за цикл, равна количеству полученной извне теплоты.
Однако в результате кругового процесса система может теплоту как получать, так и отдавать, поэтому
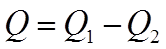
Q1 – количество теплоты, полученное системой;
Q2 – количество теплоты, отданное системой
Холодильные машины
Любой участок цикла Карно и весь цикл в целом может быть пройден в обоих направлениях. Обход цикла по часовой стрелке соответствует тепловому двигателю, когда полученное рабочим телом тепло частично превращается в полезную работу. Обход против часовой стрелки соответствует холодильной машине, когда некоторое количество теплоты отбирается от холодного резервуара и передается горячему резервуару за счет совершения внешней работы. Поэтому идеальное устройство, работающее по циклу Карно, называют обратимой тепловой машиной. В реальных холодильных машинах используются различные циклические процессы. Все холодильные циклы на диаграмме (p , V ) обходятся против часовой стрелки.
Устройство, работающее по холодильному циклу, может иметь двоякое предназначение. Если полезным эффектом является отбор некоторого количества тепла |Q 2 | от охлаждаемых тел (например, от продуктов в камере холодильника), то такое устройство является обычным холодильником. Эффективность работы холодильника можно охарактеризовать отношением
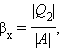
т. е. эффективность работы холодильника – это количество тепла, отбираемого от охлаждаемых тел на 1 джоуль затраченной работы. При таком определении βх может быть и больше, и меньше единицы. Для обращенного цикла Карно
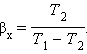
Если полезным эффектом является передача некоторого количества тепла |Q 1 | нагреваемым телам (например, воздуху в помещении), то такое устройство называется тепловым насосом. Эффективность βТ теплового насоса может быть определена как отношение
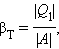
т. е. количеством теплоты, передаваемым более теплым телам на 1 джоуль затраченной работы. Из первого закона термодинамики следует:
|Q 1 | > |A |,
Следовательно, βТ всегда больше единицы. Для обращенного цикла Карно
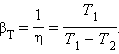
Вопрос
Явления переноса. Теплопроводность. Коэффициент теплопроводности. Закон Фурье.
Явление переноса - В результате хаотического движения молекул и соударений между ними происходят непрерывные изменения их скоростей и энергий в веществе. Если в веществе существует пространственная неоднородность плотности, температуры или скорости упорядоченного движения отдельных слоев вещества, то на беспорядочное тепловое движение молекул вещества накладывается упорядоченное движение, которое ведет к выравниванию этих неоднородностей. Эти явления называются явлениями переноса.
Таким образом, явления переноса – это группа явлений, обусловленных хаотическим тепловым движением молекул и приводящих к направленному переносу энергии (теплопроводность), количества движения (внутреннее трение) или массы (диффузия). Во всех трех явлениях имеется много общего, а именно в среде происходит направленный перенос какой-либо физической величины (энергии, количества движения, массы) из одной части вещества в другую до тех пор, пока данная величина не распределится равномерно по всему объему.
Теплопроводность -способность материальных тел к переносу энергии (теплообмену) от более нагретых частей тела к менее нагретым частям тела, осуществляемому хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.). Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества.
Коэффициент теплопроводности - в газах коэффициент теплопроводности может быть найден по приближённой формуле.
X 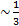 p
p 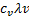 = Dp
= Dp 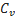
λ- средняя длина свободного пробега молекул газа
v- средняя тепловая скорость
p- плотность газа, а не давление
1. 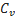 - удельная теплоёмкость при постоянном объёме
- удельная теплоёмкость при постоянном объёме
Многие коэф. есть в таблице коэффициентов теплопроводности различных материалов.
Закон теплопроводности Фурье –
{\displaystyle {\vec {q}}}
Вязкость.
Вя́зкость (вну́треннее тре́ние) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. В результате работа, затрачиваемая на это перемещение, рассеивается в виде тепла.
Сила вязкого трения, действующая по площади 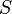 на слой жидкости (газа), параллельный скорости течения
на слой жидкости (газа), параллельный скорости течения 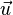 , со стороны нижележащего слоя дается законом Ньютона:
, со стороны нижележащего слоя дается законом Ньютона:
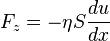
Велична 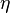 называется коэффициентом вязкости.
называется коэффициентом вязкости.
Закон вязкости Ньютона.
Закон вязкости Ньютона-это выражающая пропорциональность напряжения трения междудвумя слоями прямолинейно движущейся вязкой жидкости относительной скоростискольжения этих слоев, т. е. отнесённому к единице длины изменению скоростипо нормали к направлению движения. В соответствиис этим законом напряжения трения т, действующее на поверхности элементарногообъёма жидкости или газа, пропорц. градиенту скорости du/dy, где и- составляющая скорости жидкости вдоль поверхности, а у - координата, <нормальная поверхности:

Коэф. пропорциональности 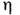 наз. <коэф. внутр. трения жидкости или динамич. коэф. вязкости
наз. <коэф. внутр. трения жидкости или динамич. коэф. вязкости
Диффузия.
Закон Фика. Средняя скорость течения газа определяется формулой
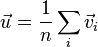
где суммирование выполняется по всем молекулам газа в единице объема. Плотность потока частиц равна
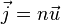
Помимо движения газа как целого существет процесс пространственного перераспределения компонент смеси относительно друг друга, обусловленный случайным движением молекул. Это неравновесный процесс, который называется диффузией.
Пусть имеется бинарная смесь с плотностью 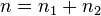 .
.
Пусть средняя скорость тесения газа 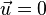 , а диффузия осуществляется только вдоль оси
, а диффузия осуществляется только вдоль оси 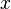 . Тогда плотности потоков компонентов смеси даются законом Фика:
. Тогда плотности потоков компонентов смеси даются законом Фика:
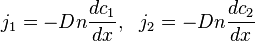
Следует, что 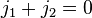 . Это означает, что диффузия сама по себе не менят плотности среды.
. Это означает, что диффузия сама по себе не менят плотности среды.
Величина 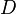 называется коэффициентом диффузии.
называется коэффициентом диффузии.
Если 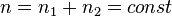 , то формула закона Фика принимают более простой вид
, то формула закона Фика принимают более простой вид
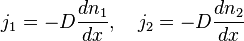
Теплопроводность.
Теплопроводность - это один из видов переноса тепла от более нагретых частей вещества к менее нагретым.
Плотность потока тепла 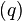 - это кол-во тепловой энергии, пересекающей единичную площадь за единицу времени.
- это кол-во тепловой энергии, пересекающей единичную площадь за единицу времени.
Для одномерного переноса тепла плотность потока тепла определяется законом Фурье:
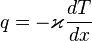
Величина 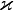 называется коэффициентом теплопроводности.
называется коэффициентом теплопроводности.
В трехмерном случае плотность потока тепла - вектор
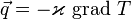
Вязкость.
Сила вязкого трения, действующая по площади 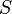 на слой жидкости (газа), параллельный скорости течения
на слой жидкости (газа), параллельный скорости течения 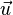 , со стороны нижележащего слоя дается законом Ньютона:
, со стороны нижележащего слоя дается законом Ньютона:
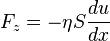
Велична 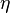 называется коэффициентом вязкости.
называется коэффициентом вязкости.
Коэффициент пропорциональности, зависящий от природы жидкости или газа, называют коэффициентом динамической вязкости
Закон вязкости (внутреннего трения) Ньютона — математическое выражение, связывающее касательное напряжение внутреннего трения τ {\displaystyle \tau } (вязкость) и изменение скорости среды v {\displaystyle v} в пространстве ∂ v / ∂ n {\displaystyle \partial v/\partial n} (градиент скорости) для текучих тел (жидкостей и газов):
τ = η ∂ v ∂ n , {\displaystyle \tau =\eta {\frac {\partial v}{\partial n}},}
где величина η {\displaystyle \eta } называется коэффициентом внутреннего трения или коэффициентом динамической вязкости (единица СГС — пуаз); с физической точки зрения она представляет собой удельную силу трения при градиенте скорости, равном единице.
В технике, в частности, при расчёте гидроприводов и в триботехнике, часто приходится иметь дело с величиной:
ν = η ρ , {\displaystyle \nu ={\frac {\eta }{\rho }},}
эта величина получила название кинематической вязкости, единица СГС — Стокс. Здесь ρ {\displaystyle \rho } — плотность среды; η {\displaystyle \eta } — коэффициент динамической вязкости.
Закон Ньютона может быть получен аналитически и приёмами физической кинетики, где вязкость рассматривается обычно одновременно с теплопроводностью и соответствующим законом Фурье для теплопроводности. В кинетической теории газов коэффициент внутреннего трения вычисляется по формуле
η = 1 3 ⟨ u ⟩ ⟨ λ ⟩ ρ , {\displaystyle \eta ={\frac {1}{3}}\left\langle u\right\rangle \left\langle \lambda \right\rangle \rho ,}
где ⟨ u ⟩ {\displaystyle \left\langle u\right\rangle } — средняя скорость теплового движения молекул, ⟨ λ ⟩ {\displaystyle \left\langle \lambda \right\rangle } − средняя длина свободного пробега.
17. Процессы. Работа газа при различных процессах.
Применим первое начало термодинамики к некото-рым процессам в идеальном газе, при которых один из термодинамических параметров остаётся постоянным.
Такие процессы называются изопроцессы.
· Изохорический процесс (V=const)
В этом процессе газ не совершает работы: 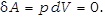
Поэтому всё тепло, сообщаемое газу, идёт на увеличе-ние его внутренней энергии: 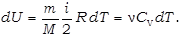
· Изобарический процесс (p=const)
При изобарическом процессе давление газа остаётся постоянным, поэтому работа газа будет равна: 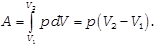
Если применить к полученному выражению уравнение состояния идеального газа, то выражение для работы газа в изобарическом процессе примет вид: 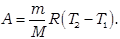
Первое начало термодинамики в этом процессе можно записать в виде: 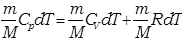
· Изотермический процесс (T=const)
·
Определим работу газа в изотермическом процессе.
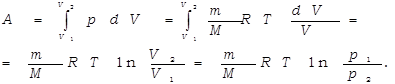
Так как в изотермическом процессе внутренняя энергия идеального газа не изменяется 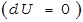 , то всё количество теплоты, подводимое к газу, расходуется на совершение им работы против внешних сил.
, то всё количество теплоты, подводимое к газу, расходуется на совершение им работы против внешних сил. 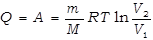
Теплоёмкость газа в изотермическом процессе бесконечно велика 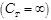 , так как изменение температуры в изотермическом процессе равно нулю
, так как изменение температуры в изотермическом процессе равно нулю 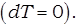
· Адиабатный процесс
Адиабатическим называется процесс, при котором отсутствует теплообмен между системой (газом) и окружающей средой.
Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками.
Для адиабатического процесса 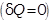 первое начало термодинамики примет вид:
первое начало термодинамики примет вид: 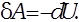
Для одного моля это выражение примет вид: 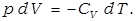
Используя уравнение состояния идеального газа, исключим давление из этого уравнения: 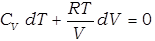
или 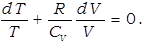
Произведя интегрирование, получим: 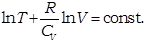
Потенцируя это выражение, имеем: 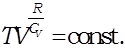
Учитывая, что 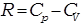 ,а
,а 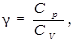
После несложных алгебраических преобразований получим:
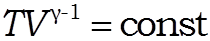 или
или 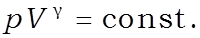
Уравнение адиабаты идеального газа в переменных и называется уравнением Пуассона.
Безразмерная величина 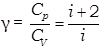 называется показателем адиабаты или коэффициентом Пуассона.
называется показателем адиабаты или коэффициентом Пуассона.
Для одноатомных газов (i=3) y=1,67
для двухатомных – 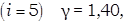
для многоатомных – 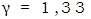 .
.
В координатах p и V процесс адиабатического расширения или сжатия газа изображается кривой, которая называется адиабатой.
При адиабатическом расширении газ совершает положительную работу, поэтому его внутренняя энергия уменьшается, а температура понижается.
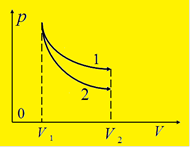
Вследствие этого давление газа при адиабатическом (2) расширении убывает быстрее, чем при изотермическом (1), а работа газа будет меньше.
Вычислим работу газа в адиабатическом процессе. 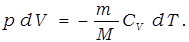
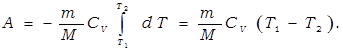
Этому выражению можно придать иной вид, если воспользоваться уравнением Майера 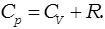
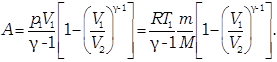
· Политропный процесс – такой процесс, при котором изменяются все основные параметры системы, кроме теплоемкости, т.е. С = const.
Уравнение политропы 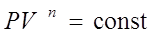 или
или
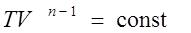
Здесь n– показатель политропы.
С помощью показателя n можно легко описать любой изопроцесс
1. Изобарный процесс Р = const, n = 0 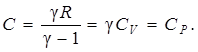
2. Изотермический процесс Т = const, n = 1, 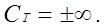
3. Изохорный процесс V = const, 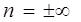 ,
, 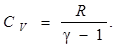
4. Адиабатический процесс DQ = 0, n = γ, Сад = 0
Во всех этих процессах работу можно вычислить по одной формуле:
Распределение частиц по потенциальным энергиям. Барометрическая формула. Распределение Больцмана.
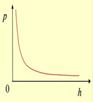 Барометрическая формула .Барометрическая формула – зависимость давления газа от высоты (в поле тяготения Земли).
Барометрическая формула .Барометрическая формула – зависимость давления газа от высоты (в поле тяготения Земли).
Два процесса:
1. тяготение,
2. тепловое хаотичное движение молекул приводят к некоторому стационарному состоянию.
Два процесса:
1. тяготение,
2. тепловое хаотичное движение молекул приводят к некоторому стационарному состоянию.
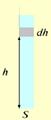 Предположим:
Предположим:
1) идеальный газ, m = const,
2) поле тяготения однородно, g = const,
3) T = const. сила давления столба воздуха высотой dh сечением S.
m – масса молекулы.
n – концентрация молекул.
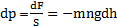 .
.
Знак «–» отражает то, что с увеличением h давление p падает.
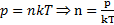 .
.
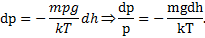
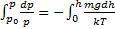
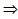
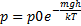
Применение: прибор для измерения высоты над поверхностью земли – высотомер (альтиметр). Для концентрации молекул.
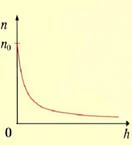
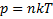
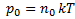

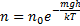
Распределение молекул по потенциальным энергиям
(Распределение Больцмана)
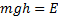 ,
, 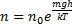 потенциальная энергия в поле тяготения
потенциальная энергия в поле тяготения
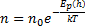 - распределение Больцмана. Больцман показал, что распределение такого вида справедливо для любого внешнего поля.
- распределение Больцмана. Больцман показал, что распределение такого вида справедливо для любого внешнего поля.
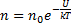 -
- 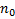 – концентрация молекул с нулевой потенциальной энергией
– концентрация молекул с нулевой потенциальной энергией 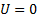
23. Энтропия. Второе начало термодинамики. Теорема Нернста.
Энтропи́я (поворот, превращение) — в естественных науках мера неупорядоченности системы, состоящей из многихэлементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; Явление, обратное энтропии, именуется негэнтропией. Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при замкнутых обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
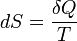
где 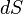 — приращение энтропии;
— приращение энтропии; 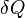 — минимальная теплота, подведённая к системе;
— минимальная теплота, подведённая к системе; 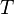 — абсолютная температура процесса.
— абсолютная температура процесса.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой).
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения. Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло 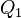 у нагревателя, отдав
у нагревателя, отдав 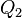 холодильнику и совершив при этом работу
холодильнику и совершив при этом работу 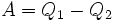 . После этого воспользуемся процессом Клаузиуса и вернем тепло
. После этого воспользуемся процессом Клаузиуса и вернем тепло 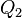 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен. С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен. С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса имеет следующий вид:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния 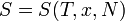 , называемая энтропией, такая, что ее полный дифференциал
, называемая энтропией, такая, что ее полный дифференциал 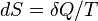
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Формулировка
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
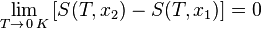
Или
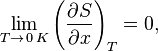
где 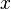 — любой термодинамический параметр.
— любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение):
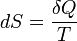
Третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики). В классической термодинамике энтропия может быть определена лишь с точностью до роизвольной аддитивной постоянной 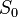 , что не мешает термодинамическим исследованиям, так как реально измеряется разность энтропий
, что не мешает термодинамическим исследованиям, так как реально измеряется разность энтропий 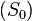 в различных состояниях. Согласно третьему началу термодинамики, при
в различных состояниях. Согласно третьему началу термодинамики, при 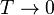 значение
значение 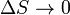 .
.
В 1911 году Макс Планк сформулировал третье начало термодинамики как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю: 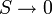 . Отсюда
. Отсюда 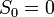 , что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность
, что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность 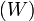 состояния системы
состояния системы 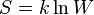 . При абсолютном нуле температуры система находится в основном квантово-механическом состоянии. Если оно невырожденно, то
. При абсолютном нуле температуры система находится в основном квантово-механическом состоянии. Если оно невырожденно, то 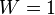 (состояние реализуется единственным микрораспределением) и энтропия
(состояние реализуется единственным микрораспределением) и энтропия 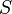 при
при 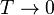 равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем могут стать существенными дискретность квантовых уровней макроскопической системы и влияние квантового вырождения.
равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем могут стать существенными дискретность квантовых уровней макроскопической системы и влияние квантового вырождения.
Тепловые машины
Тепловой машиной называется периодически действующий двигатель, совершающий работу за счет получаемого извне тепла. 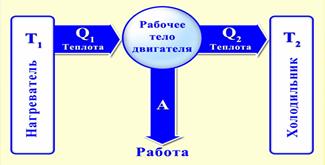
КПД
Коэффициент полезного действия (КПД) — характеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии. Определяется отношением полезно использованной энергии к суммарному количеству энергии, полученному системой; обозначается обычно η . КПД является безразмерной величиной и часто измеряется в процентах.
Максимальным КПД обладают машины у которых только обратимые процессы.
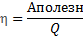
η - коэффициент полезного действия(КПД) теплового двигателя
Аполезн - полезная работа, совершенная двигателем, Дж.
Q – общее количество теплоты, полученное двигателем, Дж.
КПД= 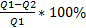
КПД – коэф. полезного действия теплового двигателя
Q1 - количество теплоты, полученное рабочим телом от нагревателя.
Q2 - количество теплоты, отданное рабочим телом холодильнику
Теорема карно
Из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей и холодильников, наибольшим КПД обладают обратимые машины. Причем КПД обратимых машин, равны друг другу и не зависят от конструкции машины и от природы рабочего вещества.
При этом КПД меньше единицы.
Цикл, изученный Карно, является самым экономичным и представляет собой круговой процесс, состоящий из двух изотерм и двух адиабат.
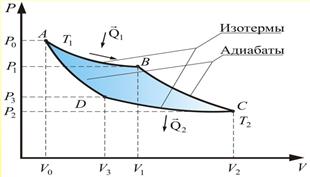
Тепловой машиной называется периодически действующий двигнатель, совершающий работу за счет, получаемого изве тепла и имеющего нагрватель,холодильник и рабочее тело.
Будем считат, что нагрватель и холодильник имеют бесконченую теплоемкость, т.е. их температуры не изменяются в процессе передачи тепла.
Как видим, на всех стадиях крувого процесса нигде не допускается сопрокосновенность тел с разной температурой, т.е. нет необратимых процессов теплопроводности. Весь цикл проводится обратимо(бесконечно медленно), значит η-max.
Из равенства следует 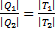
Итак, полезная работа A = 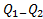
КПД η равен: η= 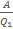 =
= 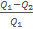 =1-
=1- 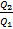 =1-
=1- 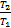
Видно, что η <1 зависит от разности температур между нагревателем и холодильником (и не зависит от конструкции машины и рода рабочего тела) .
Это еще одна формулировка теоремы Карно.
Цикл Карно, рассмотренный выше, был на всех стадиях проведен так, что не было необратимых процессов, (не было соприкосновения тел с разными температура
