Электрический ток в жидкостях. Диссоциация. Электролиз.
Жидкости по степени электропроводности делятся на: диэлектрики (дистиллированная вода), проводники(электролиты), полупроводники (расплавленный селен).
Электролит - это проводящая жидкость (растворы кислот , щелочей, солей и расплавленные соли). Электролитическая диссоциация (разъединение) - при растворении в результате теплового движения происходят столкновения молекул растворителя и нейтральных молекул электролита. М олекулы распадаются на положительные и отрицательные ионы. Например, растворение медного купороса в воде.
Степень диссоциации - доля молекул, распавшихся на ионы; - возрастает с увеличением температуры; - еще зависит от концентрации раствора и от электрических свойств растворителя.
Электропроводимость электролитов. Ионная проводимость - упорядоченное движение ионов под действием внешнего эл.поля; существует в электролитах; прохождение эл.тока связано с переносом вещества.
Электронная проводимость - также в небольшой мере присутствует в электролитах , но в основном характеризует электропроводимость жидких металлов. Ионы в электролите движутся хаотически до тех пор, пока в жидкость не опускаются электроды, между которыми существует разность потенциалов. Тогда на хаотическое движение ионов накладывается их упорядоченное движение к соответствующим электродам и в электролите возникает эл. ток.
Зависимость сопротивления электролита от температуры. Температурная зависимость сопротивления электролита объясняется в основном изменением удельного сопротивления. , где альфа - температурный коэффициент сопротивления.
Для электролитов всегда 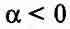
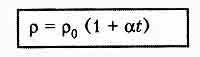
Сопротивление электролита можно рассчитать по формуле:Явление электролиза - сопровождает прохождение эл.тока через жидкость; - это выделение на электродах веществ, входящих в электролиты; Положительно заряженные анионы под действием электрического поля стремятся к отрицательному катоду, а отрицательно заряженные катионы - к положительному аноду. 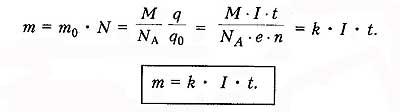 .На аноде отрицательные ионы отдают лишние электроны ( окислительная реакция ) На катоде положительные ионы получают недостающие электроны ( восстановительная реакция ).
.На аноде отрицательные ионы отдают лишние электроны ( окислительная реакция ) На катоде положительные ионы получают недостающие электроны ( восстановительная реакция ).
Закон электролиза. 1833г. - Фарадей Закон электролиза определяет массу вещества, выделяемого на электроде при электролизе за время прохождения эл.тока . 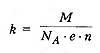 k - электрохимический эквивалент вещества, численно равный массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл. Зная массу выделившегося вещества, можно определить заряд электрона.Закона электромагнитной индукции Фарадея: какова бы ни была причина изменения потока магнитной индукции, охватываемого замкнутым проводящим контуром, возникающая в контуре э. д. с.
k - электрохимический эквивалент вещества, численно равный массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл. Зная массу выделившегося вещества, можно определить заряд электрона.Закона электромагнитной индукции Фарадея: какова бы ни была причина изменения потока магнитной индукции, охватываемого замкнутым проводящим контуром, возникающая в контуре э. д. с.
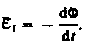
Знак минус показывает, что увеличение потока 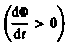 вызывает э. д. с.
вызывает э. д. с. 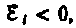 т. е. поле индукционного тока направлено навстречу потоку; уменьшение потока
т. е. поле индукционного тока направлено навстречу потоку; уменьшение потока 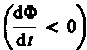 вызывает
вызывает 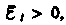 т.е. направления потока и поля индукционного тока совпадают. Знак минус в формуле (123.2) определяется правилом Ленца — общим правилом для нахождения направления индукционного тока, выведенного в 1833 г.
т.е. направления потока и поля индукционного тока совпадают. Знак минус в формуле (123.2) определяется правилом Ленца — общим правилом для нахождения направления индукционного тока, выведенного в 1833 г.
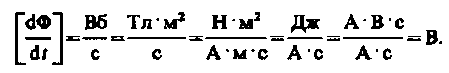
Закон Фарадея можно сформулировать еще таким образом: э.д.с. 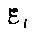 электромагнитной индукции в контуре численно равна и противоположна по знаку скорости изменения магнитного потока сквозь поверхность, ограниченную этим контуром. Этот закон является универсальным: э. д. с.
электромагнитной индукции в контуре численно равна и противоположна по знаку скорости изменения магнитного потока сквозь поверхность, ограниченную этим контуром. Этот закон является универсальным: э. д. с. 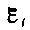 не зависит от способа изменения магнитного потока. Э.д.с. электромагнитной индукции выражается в вольтах. Действительно, учитывая, что единицей магнитного потока является вебер (Вб), получим (сверху).
не зависит от способа изменения магнитного потока. Э.д.с. электромагнитной индукции выражается в вольтах. Действительно, учитывая, что единицей магнитного потока является вебер (Вб), получим (сверху).
