Описание экспериментальной установки и методики эксперимента.
Прежде чем рассмотреть схему экспериментальной установки и приступить к выводу рабочей формулы, рассмотрим два мысленных эксперимента.
Первый эксперимент. В произвольной изолированной системе С находятся две механически изолированные, закрытые системы А и В (рис. 1). Пусть в начальный момент времени давление и температура в системе А равны соответственно р1 и T1, а в системе В - р2 ≠ p1 и Т2 ≠ T1.
По условию эксперимента, системы А и В не являются изолированными, так как могут обмениваться между собой теплом.
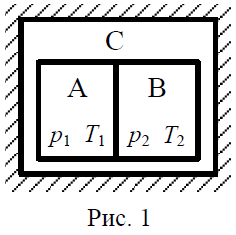
В этом случае за счёт теплообмена, через конечный промежуток времени ∆τ1, температура в системах А и В станет одинаковой (Т1' = Т2') и теплообмен прекратится. Так как рассматриваемые системы механически изолированы друг от друга, то выравнивание температур в них, в общем случае, не приводит к выравниванию давлений, т.е. р1' ≠ р2'.
Таким образом, в этом эксперименте между системами А и В устанавливается только термическое (тепловое) равновесие.
Второй эксперимент. Пусть в изолированной системе С находятся адиабатически изолированные, закрытые системы А и В, которые механически взаимодействуют друг с другом (см. рис. 1). Допустим, что в начальный момент времени давление и температура в системе А равны соответственно р1 и Т1, а в системе В - р2 ≠ р1 и Т2 ≠ T1. Так как системы механически не изолированы, то через конечный промежуток времени ∆τ2 между ними устанавливается механическое равновесие (т.е. р1' = р2'). По условию эксперимента, системы А и В адиабатически изолированы. Следовательно, в конечном состоянии температура в них, в общем случае, будет разной (Т1' ≠ Т2').
Многочисленные эксперименты показали, что длительность процессов установления теплового и механического равновесия между термодинамическими системами, происходящих в достаточно большом объёме газа, различна, а именно ∆τ1 >> ∆τ2.
На этом экспериментально установленном факте и основан метод определения показателя адиабаты воздуха, предложенный Николя Клеманом и Шарль-Бенаром Дезормом в 1819 г..
Схема лабораторной установки приведена на рис. 2 и включает в себя стеклянный баллон 1 объемом 19 литров, соединенного с открытым водяным U- манометром 4 и ручным насосом (компрессором) 2.
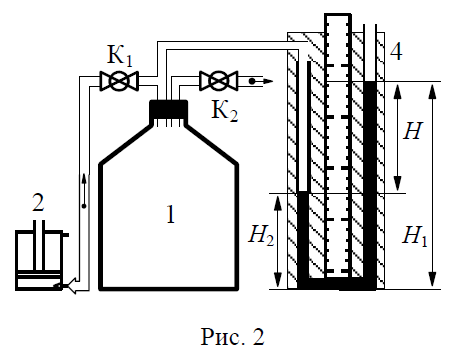
В лабораторной установке имеются также краны К1 и К2.
Напускной кран К1 соединяет баллон с ручным насосом 2, предназначенным для нагнетания в баллон некоторого количества воздуха. Этот кран также позволяет устанавливать уровень воды в коленах U-манометра после заполнения баллона воздухом.
Открытый водяной U-манометр 4 служит для измерения избыточного давления ∆p в баллоне:
∆p = p - p0 = pgH = pg(H1 - H2) (1)
Здесь р - давление воздуха в баллоне; р0 - атмосферное давление; p - плотность воды; H - разность уровней воды в коленах манометра; H1 - высота столба воды в правом колене манометра; H2 - высота воды в левом колене манометра.
Кран сброса воздуха (выпускной кран) К2 предназначен для быстрого (практически без теплообмена с окружающей средой) сброса части газа из баллона в окружающую среду, приводящего к резкому уменьшению давления в баллоне.
Для определения показателя адиабаты γ с воздухом, изначально находящимся в баллоне, проводят последовательность термодинамических процессов, представленных на р-V-диаграмме (рис. 3), основным из которых является процесс адиабатического расширения воздуха 1 → 2 и изохорического нагрева газа в баллоне 2 → 3. Рассмотрим процессы, из которых состоит эта диаграмма, и определим значения термодинамических параметров состояния воздуха в ее характерных точках.
Состояние A (начальное состояние).
Температура воздуха в баллоне объемом V0 равна комнатной температуре T0, а давление в нем равно атмосферному давлению р0(краны К1 и К2 находятся в положении «Открыто»). Пусть М0 - масса воздуха в баллоне.
