Закон эквивалентов и его применение в титриметрии. Золотое правило аналитики. Применение золотого правила аналитики в титриметрии и при приготовлении растворов.
Кислотно-основное титрование. Сущность метода. Классификация методов кислотно-основного титрования. Примеры применения в анализе лекарственных средств.
Кислотно-основные реакции, сущность которых сводится к взаимодействию между собой в водных растворах ионов гидроксония и гидроксильных ионов:
Н3О+ + ОН¯ = 2Н2О или Н+ + ОН¯ = Н2О
суть кислотно-основного взаимодействия состоит в
переносе протонов от кислоты (донор протонов) к основанию (акцептор протонов).
Свойство соединений вступать в кислотно-основное взаимодействие характеризуется константой диссоциации. Для кислот константа равновесия обозначается Kа, а для
оснований – Kв . рКА = - lg КА ; рКВ = - lg КВ
Чем больше рКА основания, тем оно сильнее и соответственно, чем
меньше рКА кислоты, тем она сильнее.
Метод кислотно-основного титрования применяется для количественного определения кислот, оснований или солей, способных гидролизоваться в водных растворах. В зависимости от природы используемого титранта кислотно-основное титрование подразделяется на ацидиметрию (acidium-кислота) и алкалиметрию(alkalis – щёлочь).
Алкалиметрия. Приготовление 0,1 М раствора NaOH без карбонатов по ГФ 12. Установка титра раствора гидроксида натрия по гидрофталату калия.
В алкалиметрии в качестве титрантов используют растворы щелочей (NaOH, KOH, Ba(OH)2), в которых молярная концентрация эквивалента вещества колеблется в интервале от 0,01 моль/дм3 до 0,2 моль/дм3.
0,1 М раствор натрия гидроксида. 0,1 М раствор натра едкого.
100,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. 45,0 мл 1 М раствора хлористоводородной кислоты титруют приготовленным раствором натрия гидроксида (индикатор-фенолфталеин). К оттитрованному раствору прибавляют по каплям 1 М раствор хлористоводородной кислоты до исчезновения розового окрашивания и кипятят до объема ~ 20 мл. В процессе кипячения при возникновении розового окрашивания прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Раствор охлаждают и, при наличии розовой окраски, прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Суммарное количество прибавленного 1 М раствора хлористоводородной кислоты не должно превышать 0,1 мл.
Установка титра (1). 45,0 мл 0,5 М раствора хлористоводородной кислоты титруют полученным раствором натрия гидроксида, используя в качестве индикатора 0,5-1 мл 0,1% раствора фенолфталеина.
1 мл 1 М раствора хлористоводородной кислоты соответствует 40,00 мг NaOH.
Установка титра (2). Около 5 г (точная навеска) калия гидрофталата РО, предварительно тонко измельченного и высушенного при температуре 120 град. С в течение 2 ч, растворяют в 75 мл воды и титруют приготовленным раствором натра едкого (индикатор-фенолфталеин).
1 мл 1 М раствора натрия гидроксида соответствует 204,22 мг C8H5KO4.
Титр устанавливают непосредственно перед использованием.
23.Перманганатометрия. Сущность метода. Применение перманганатометрии для определения восстановителей, окислителей, нейтральных веществ.
Перманганатометрическое титрование, или перманганатометрия, — метод количественного определения веществ (восстановителей, реже — окислителей и соединений, не обладающих окислительно-восстановительными свойствами) с применением титранта — раствора перманганата калия КМnO4.
Сущность метода. Перманганат калия — сильный окислитель, обладающий интенсивной фиолетово-малиновой окраской. В зависимости от кислотности титруемого раствора окислительные свойства перманганат-иона проявляются по-разному.
В сильнокислой среде (рН<<7) перманганат-ион восстанавливается до катионов марганца(II) Мn2+, которые обладают очень слабой розоватой окраской (практически бесцветны):
МnО4 ‾+ 5е + 8Н+ = Мn2+ + 4Н2O
В нейтральной среде перманганат-ион восстанавливается до диоксида марганца МnО2.
МnО4 ‾ + 3е + 2Н2O = МnО2 + 4OН‾
В сильнощелочных средах перманганат-ион восстанавливается до манганат-иона
МnО4 ‾ + е = МnО42‾
Образующийся манганат-ион обладает зеленой окраской умеренной интенсивности, окрашивает раствор в зеленый цвет, что затрудняет обнаружение изменения окраски раствора и фиксацию КТТ. Манганат-ион вступает в реакцию с водой:
3 МnО42‾ + 2Н2O = 2 МnО4 ‾ + МnО2↓ +40Н‾
Приготовление 0,05 M раствора эдената натрия (трилона Б) по ГФ12. Установка титра эдената натрия.
0,05 М раствор натрия эдетата. 0,05 М раствор трилона Б.
18,6 г натрия эдетата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,100 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и добавляют 0,1 мл бромной воды. избыток брома удаляют кипячением, прибавляют 2 М раствор натрия гидроксида до слабокислой или нейтральной реакции, разбавляют водой до 200 мл, прибавляют 50 мг индикаторной смеси ксиленолового оранжевого и достаточное количество гексаметилентетрамина до фиолетово-розового окрашивания, прибавляют еще 2 г гексаметилентетрамина и титруют приготовленным раствором натрия эдетата до изменения окраски от фиолетово-розовой к желтой.
1 мл 0,05 М раствора натрия эдетата соответствует 3,269 мг Zn.
Закон эквивалентов и его применение в титриметрии. Золотое правило аналитики. Применение золотого правила аналитики в титриметрии и при приготовлении растворов.
1. Прямое титрование – наиболее распространенный и удобный прием, когда к анализируемому раствору добавляют рабочий раствор.
Массу определяемого вещества m(A) определяют в данном случае по формуле (6)
2. Титрование заместителя (косвенный метод) применяют, когда нет подходящей реакции или индикатора для прямого тестирования. В этом случае используют какую-либо реакцию, в которой анализируемое вещество замещают эквивалентным количеством другого вещества, а последнее титруют рабочим раствором. Массу определяемого вещества m(A) рассчитывают по формуле (6).
3. Обратное титрование (титрование остатка) используют в тех случаях, когда прямое титрование невозможно или когда анализируемое вещество неустойчиво. При этом применяют два рабочих раствора. К раствору определяемого вещества (А) добавляют избыток рабочего раствора (В), а когда реакция заканчивается, остаток В титруют рабочим раствором С.
Таким образом, масса определяемого вещества (А) рассчитывается в этом случае по формуле:
7.Приготовление стандартного раствора на примере первичного стандарта. Рассмотреть на примере приготовления стандартного раствора дихромата калия С(1/6К2Сr2O7).Стандартный раствор метода – раствор дихромата калия, который готовят точной концентрации из х.ч. K2Cr2O7 по точной навеске в мерной колбе или из ампулы «фиксанал».
Метод дихроматометрии применяют в солянокислой и сернокислой средах.
Ионы Cl- не окисляются дихроматом калия, т.к. стандартный окислительно-восстановительный потенциал пары
j 0 Cl2 / 2Cl- = + 1,36 B
практически равен стандартному окислительно-восстановительному потенциалу пары
j 0 Cr2O72-/2Cr3+ = + 1,33 В.
Для определения точки эквивалентности в методе дихроматометрии применяют окислительно-восстановительные индикаторы (редоксиндикаторы) – это вещества, которые изменяют свою окраску в зависимости от окислительно-восстановительного потенциала системы.
Методом дихроматометрии анализируют:
• восстановители - способом прямого титрования или титрованием по способу замещения, если j 0 восст. < j 0 Fe3+ / Fe2+;
• окислители - способом обратного титрования;
• органические вещества (глицерин, альдегиды, сахара) - способом обратного титрования.
Преимущества метода
1. K2Cr2O7 строго соответствует химической формуле.
2. Стандартный раствор дихромата калия можно приготовить точной концентрации из химически чистого вещества, которое можно получить путем перекристаллизации, или из ампулы «фиксанал».
3. Стандартный раствор дихромата калия устойчив при хранении и не разлагается при кипячении.
4. Метод дихроматометрии можно проводить в сернокислой и солянокислой средах.
Недостатки метода
11. Требования, предъявляемые к титриметрическим реакциям. Способы титрования. Сопроводите примерами. Требования, предъявляемые к реакциям в титриметрическом анализе Реакции, используемые в титриметрическом анализе, должны отвечать следующим основным требованиям: 1) Реакция должна протекать по строго определенному стехиометриче- скому уравнению. Побочные реакции должны быть исключены. 2) Реакция должна протекать количественно, т. е. практически до конца. Степень превращения исходных веществ в продукты реакции в ТЭ должна быть не менее 99,9-99,99 %. 3) Реакция должна протекать быстро, чтобы в любой момент титрования равновесие устанавливалось практически мгновенно. 4) Реакция должна позволять точно и удобно определять КТТ вблизи ТЭ.
В титриметрическом анализе применяют прямое титрование; обратное титрование; косвенное титрование, или титрование заместителя. Прямое титрование – это такое титрование, когда определяемое вещество непосредственно титруется стандартным раствором титранта или наоборот.9 В обратном титровании осуществляют титрование непрореагировав- шего вещества, которое прибавлено в избытке к анализируемому раствору в виде стандартного раствора. Косвенное титрование – титрование, при котором определяемое веще- ство не реагирует с титрантом непосредственно, а определяется косвенно в ре- зультате использования стехиометрически протекающей реакции с образовани- ем другого вещества, реагирующего с титрантом.
12. Элементы математической обработки результатов анализа. Классификация ошибок. Однородная и неоднородная выборка.Погрешности подразделяются на систематические, случайные и грубые (промахи).
Систематические погрешности-погрешности, которые, практически не изменяясь за время опыта, одинаковым образом входят в каждый результат измерений, вызывая смещение
Случайные погрешности. Это неопределенные по величине и знаку погрешности, в появлении которых не наблюдается какой-либо закономерности. Они могут быть вызваны изменением температуры, влажности воздуха и т. п.
Случайные погрешности в отличие от систематических, нельзя устранить, предусмотреть, ввести на них поправку..
Грубые погрешности (промахи) – погрешности, сильно искажающие результат анализа. К ним относятся погрешности зависящие, например, от неправильного отсчета по шкале бюретки при титровании, от просыпания части осадка или от проливания части раствора и т. д. Математическая обработка результатов анализа. Для уменьшения влияния случайных погрешностей на результат анализа обычно проводят не одно, а три и более определений исследуемого компонента в данном веществе. Математическую обработку результатов анализа проводят по след. формулам (Xi – отдельные измерения, n – количество измерений)
Среднее арифметическое 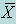 | 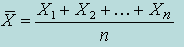 | |
| Стандартное отклонение (погрешность единичного определения) S | 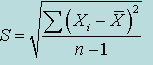 | |
Стандартное отклонение среднего арифметического (погрешность среднего арифметического) 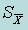 | 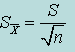 | |
| Доверительный интервал (абсолютная погрешность) ε | 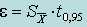 | |
| Представление результатов анализа | Хср+ε |
13. Грубые ошибки. Применение Q-критерия для оценки сомнительной величины.Грубые погрешности (промахи) – погрешности, сильно искажающие результат анализа. К ним относятся погрешности зависящие, например, от неправильного отсчета по шкале бюретки при титровании, от просыпания части осадка или от проливания части раствора и т. д. Из-за промахов результат данного определения становится неверным, и поэтому он отбрасывается при выводе среднего из серии параллельных определений.
Q-критерий в общем виде вычисляется по формуле:
Q= 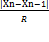 ; R=Xmax - Xmin Рассчитанное значение Q сравнивают с табличным значением. Если рассчитанное значение критерия больше табличного значения (Qрас > Qтаб), то подозрительный результат (который мы избрали) является выбросом(погрешностью) и исключается. Если рассчитанное значение не близко к табличному, результат не является погрешностью, и расчеты далее проводим с данным результатом.
; R=Xmax - Xmin Рассчитанное значение Q сравнивают с табличным значением. Если рассчитанное значение критерия больше табличного значения (Qрас > Qтаб), то подозрительный результат (который мы избрали) является выбросом(погрешностью) и исключается. Если рассчитанное значение не близко к табличному, результат не является погрешностью, и расчеты далее проводим с данным результатом.
14. Однородные выборки. Среднее значение. Единичное отклонение. Дисперсия и стандартное отклонение. Выборка — конечный набор прецедентов (объектов, случаев, событий, испытуемых, образцов, и т.п.), некоторым способом выбранных из множества всех возможных прецедентов, называемого генеральной совокупностью. Выборка называется однородной, если все её прецеденты 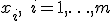 одинаково распределёны, то есть выбраны из одного и того же распределения
одинаково распределёны, то есть выбраны из одного и того же распределения 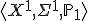 .
.
Среднее арифметическое — наиболее распространенная оценка среднего значения распределения. Она является результатом деления суммы всех наблюдаемых числовых величин на их количество. Для выборки, состоящей из чисел Х1, Х2, …, Хn, выборочное среднее (обозначаемое символом 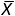 ) равно
) равно 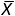 = (Х1+ Х2+ … + Хn) /n,или
= (Х1+ Х2+ … + Хn) /n,или
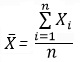 где
где 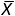 — выборочное среднее, n — объем выборки, Xi – i-й элемент выборки.
— выборочное среднее, n — объем выборки, Xi – i-й элемент выборки.
Дисперсия и стандартное отклонениепозволяют оценить степень колебания данных вокруг среднего значения. Выборочная дисперсия является приближением среднего арифметического, вычисленного на основе квадратов разностей между каждым элементом выборки и выборочным средним. Для выборки Х1, Х2, … Хn выборочная дисперсия (обозначаемая символом S2 задается следующей формулой:
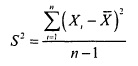 где
где 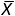 — арифметическое среднее, n — объем выборки, Xi — i-й элемент выборки X.
— арифметическое среднее, n — объем выборки, Xi — i-й элемент выборки X.
Наиболее практичной и широко распространенной оценкой разброса данных является стандартное выборочное отклонение. Этот показатель обозначается символом S и равен квадратному корню из выборочной дисперсии:
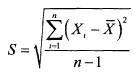
17. Общие способы определения чистоты препарата неорганического происхождения. Эталонный и безэталонный методы.
Основным принципом в требованиях к чистоте ЛС является отсутствие или ограничеснное содержание тех примесей, которые могут отрицательно влиять на физико-химические и фармакологические свойства.
Безэталонный метод. В случаях, когда в частной ФС на лекарственное вещество указано, что примесного вещества или иона «не должно быть», проводится испытание на это примесное вещество или ион. Так, В воде очищенной не должно быть примесей ионов Cl- и Са2+; реакция на эти ионы должна быть отрицательной.
Эталонный метод. проводят количественную оценку с помощью соответствующих эталонных растворов – на цветность, мутность, примесные вещества и ионы.
Эталонные растворы содержат определенное количество примесного иона или примесного вещества. Их готовят из соответствующих веществ взятием навески с точностью до 0,001 г. Готовят растворы А (для длительного хранения) и из них – рабочие растворы Б и В путем разведения до нужной концентрации.
Допустимое количество примесей в ЛВ может быть определено также путем титрования (например, количество HI в 10 %-ном спиртовом растворе йода определяют титрованием NaOH).
18. Понятие о водородном показателе. Методы определения водородного показателя в фармации.)Водородный показатель – рН – это мера активности ионов водорода в растворе, количественно выражающая его. pН = – lg[H+]
Определение рНДля определения значения pH растворов широко используют несколько способов.
1) Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы – органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы Для расширения рабочего интервала измерения pH используют универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
2) Аналитический объёмный метод – кислотно-основное титрование – также даёт точные результаты определения общей кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности – момент, когда титранта точно хватает, чтобы полностью завершить реакцию, – фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется общая кислотность раствора.
Кислотно-основное титрование. Сущность метода. Классификация методов кислотно-основного титрования. Примеры применения в анализе лекарственных средств.
Кислотно-основные реакции, сущность которых сводится к взаимодействию между собой в водных растворах ионов гидроксония и гидроксильных ионов:
Н3О+ + ОН¯ = 2Н2О или Н+ + ОН¯ = Н2О
суть кислотно-основного взаимодействия состоит в
переносе протонов от кислоты (донор протонов) к основанию (акцептор протонов).
Свойство соединений вступать в кислотно-основное взаимодействие характеризуется константой диссоциации. Для кислот константа равновесия обозначается Kа, а для
оснований – Kв . рКА = - lg КА ; рКВ = - lg КВ
Чем больше рКА основания, тем оно сильнее и соответственно, чем
меньше рКА кислоты, тем она сильнее.
Метод кислотно-основного титрования применяется для количественного определения кислот, оснований или солей, способных гидролизоваться в водных растворах. В зависимости от природы используемого титранта кислотно-основное титрование подразделяется на ацидиметрию (acidium-кислота) и алкалиметрию(alkalis – щёлочь).
