D. A. Dean, K. Kunsano-Kretzner, E. J. Mayer, 1 страница
Генная инженериярастений: применение415
D. E. Rochester,S. G.Rogers, R. T. Fraley.
1987. Insect tolerant tomato plants. Bio/Technology 5: 807-813.
Fitchen J. H., R.N. Beachj.1993. Genetically engineering protection against viruses in transgenic plants. Annu. Rev. Microb'tol. 47: 739—763.
Fuchs M., D. Gonsalves. 1995. Resistance of transgenic hybrid squash Z\V-20 expressing the coat protein genes of zucchini yellow mosaic virus and watermelon mosaic virus 2 to mixed infections by both potyviruses. Bio/Technology 13:1466-1473.
Gray J. E., S. Picton, J, J. Giovannoni, D. Grierson.1994. The use of transgenic and naturally occurring mutants to understand and manipulate tomato fruit ripening. Plant Cell Environ. 17: 557-571.
Grison R., B. Grezes-Besset, M. Schneider, N. Lucante, L. Olsen, J.-J.Lcguay, A. Toppan.1996. Field tolerance to fxmgal pathogens of Brassica napus constitutively expressing a chimeric chitinase gene. Nat. Biotechnol. 14: 643-646.
Hilder V. A., A. M. R. Gatehouse,S. E. Sheerman, R. F. Barker, D. Boulter.1987. A novel mechanism of insect resistance engineered into tobacco. Nature 330: 160-163.
Hill K. K., N. Jarvis-Eagan, E. L. Halk, K. J. Krahn, L. W. Liao, R. S. Mathewson, D. J. Merlo, S. E. Nelson, K. E.Rashka, L.S. Loesch-Fries.
1991. The development of virus-resistant alfalfa, Medtcago saliva L. Bio/Technology 9: 373—377.
Holton Τ. Α., F. Bniguera, D.R. Lester, Y. Tanaka, C. D. Hyland, J. G. T. Menting, C.-Y. Liu,
E. Farcy, T. W.Stevenson, E. C. Cornish.1993. Cloning and expression of cytochrome P450 genes controlling flower color. Nature 366: 276—279.
Johnson R., J.Narvaez, G. An, C. Ryan.1989. Expression of protease inhibitors 1 and II in transgenic tobacco plants: effects on natural defense against Manduca sexta larvae. Proc. Natl. Acad. Sei. USA 86: 9871-9875.
Jongedijk E., A. A. J. M. de Schutter, T. Stolte, P. J.M. van den Elzen, B. J. C. Cornelissen,
1992. Increased resistance to potato virus X and preservation of cultivar properties in transgenic potato under field conditions. Bio/Technology 10:422-429.
Klee H. J., M. B. Hayford, K. A.Kretzmer, G. F. Barry, G. M. Kishore.1991. Control of
ethylene synthesis by expression of a bacterial enzyme in transgenic tomato plants. Plant CW/3: 1187- 1193.
Knutzon D. S., G. A. Thompson, S. E. Radke, W. B. Johnson, V. С Knauf, J. С. Kridl.1992. Modification of Brassica seed oil by antisense expression of a stearoylacyl carrier protein desaturase gene. Proc. Natl. Acad. Sei. USA 89:2624-2628.
Lee W. S., J. T. C. Tzen( J. C. Kridl, S. E. Radke, A. H. C. Huang.1991. Maize oleosin is correctly targeted to seed oil bodies in Brassica napus transformed with the maize oleosin gene. Proc. Natl. Acad. Sei. USA 88: 6181-6185.
Lilius G., N. Holmberg, L.Bülow. 1996. Enhanced NaCl stress tolerance in transgenic tobacco expressing bacterial choline dehydrogenase. Bio/Technology 14:177-180.
Lin W., C. S. Anuratha, K. Datta, I. Potrykus, S. Muthukrishnan,S. K.Datta. 1995. Genetic engineering office for resistance to sheath blight. Bio/Technology 13: 686-691.
Ling K., S. Namba, C. Gonsalves, J. L·Slightom, D. Gonsalves.1991. Protection against detrimental effects of potyvirus infection in transgenic tobacco plants expressing the papaya ringspot virus coat protein gene. Bio/Technology 9:752-758.
Lodge J. K., W. K. Kaniewski, N. E. Turner.1993. Broad-spectrum virus resistance in transgenic plants expressing pokeweed antiviral protein. Proc. Nail. Acad. Sei. USA 90: 7089-7093.
Ma J. K.-C., M. B. Hein.1995. Immunotherapeutic potential of antibodies produced in plants. Trends Biotechnol. 13: 522-527.
Macintosh S. C., G.M. Kishore, F. J. Perlak, P. G. Marrone, T. B, Stone,S, R.Sims, R. L. Fuchs. 1990. Potentiation of Bacillus thuringien-sis insecticidal activity by serine protease inhibitors. J. Agric. FoodChem.SS: 1145-1152.
Meyer P., I.Heidmann, G. Forkmann, H.Saedler. 1987. A new petunia flower colour generated by transformation of a mutant with a maize gene. Nature 330: 677-678.
Mol J. N. M., T. A. Holton, R. E. Koes.1995. Floriculture: genetic engineering of commercial traits. Trends Biotechnol. 13: 350-355.
Mol J. N. M., A. R. van der Krol, A. J. van Tunen, R.van Blokland, P. de Lange, A. R. Stuitje.1990. Regulation of plant gene expression by antisense RNA. FEBSLett. 268:427-430.
416ГЛАВА 18
Murphy D. J. 1996. Engineering oil production in rapeseed and other oil crops. Trends Biotechnol. 14:206-213.
Nawrath C., Y. Poirier, С. Somerville. 1994. Targeting of polyhydroxybutyrate biosynthetic pathway to the plastids of Arabtdopsts thaliana results in high levels of polymer accumulation. Proc. Nail. Acad. Sei. USA 91: L2760-12764.
Panarrubia L., R. Ют, J. Giovannoni, S.-H. Kim, R. L· Fischer. 1992. Production of the sweet protein monellin in transgenic plants. Bio/Technology 10: 561-564.
Perlak F. J., R. W. Deaton, T. A. Armstrong, R. L. Fuchs, S, R. Sims, J. T. Greenplate, D. A- Fischhoff. 1990. Insect resistant cotton plants. Bio/Technolog}'8: 939-943.
IVrlak l·. J., R. L Fuchs, D. A. Dean, S. L. McPherson, D. A. Fischhoff. 1991. Modification of the coding sequence enhances plant expression of insect control protein genes. Proc. NatL Acad, Sei. USA 88: 3324-3328.
Powell P. A., D. M. Stark, P. R. Sanders, R. N. Beachy. 1989. Protection against tobacco mosaic virus in transgenic plants that express tobacco mosaic virus antisense RNA. Proc. Natl. Acad. Sei. USA 86: 6949-6952.
Quinn J. P. 1990. Evolving strategies For the genetic engineering of herbicide resistance in plants. Biotechnol. Adv. 8: 321-333.
Rooijen G. J. H., M. M. Moloney. 1995. Plant seed oil-bodies as carriers for foreign proteins. Bio/Technology 13: 72-77.
Ryan C, A. 1990. Protease inhibitors in plants: genes for improving defenses against insect and pathogens. Annu. Rev.Phytopathol 28: 425-449.
Sen Gupta A., R. P. Webb, A. S. Holaday, R. D. Allen. 1993. Overproduction of Superoxide dismutase protects plants from oxidative stress. Plant Physiol. 103: 1067-1073.
Shade R. E., H. E. Schroeder, J. J. Pueyo, L. M. Tabe, L. L. Murdock, T. J. V. Higgins, M. J. Chrispeels. 1994. Transgenic pea seeds expressing the tx-amylase inhibitor of the common bean are resistant to bruchid beetles. Bio/Technology 12: 793-796.
Shah D. M., C. M. T. Rommens, R. N. Beachy. 1995. Resistance to diseases and insects in transgenic plants: progress and applications to agriculture. Trends Bioiechnol. 13: 362-368.
Töpfer R., N. Martini, J. ScheU. 1995. Modification of plant lipid synthesis. Science 268:681—686.
Tricoli D. M., K. J. Carney, P. F. Russell, J. R. MeMaster, D. W. Groff, K. C. Hadden, P. T. Himmel, J. P. Hubbard, M. L. Boeshore, H. D. Quemada. 1995. Field evaluation of transgenic squash containing single or multiple virus coat protein gene constructs for resistance to cocumbcr mosaic virus, watermelon mosaic virus 2, and zucchini yellow mosaic virus. Bio/Technology 13: 1458-1465.
Vaeck M., A. Reynaerts, H. HOfte, S. Jansens, M. de Beuckeleer, C. Dean, M. Zabeau, M. Van Montagu, J. Leemans, 1987. Transgenic plants protected from insect attack. Nature 328: 33-37.
Van Camp W., H. WDtekens, C. Bmrter, M. Van Montagu, D. Inzé, P. Reupold-Popp, H. Sandermann, Jr., C. Langebartels. 1994. Elevated levels of Superoxide dismutase protect transgenic plants against ozone damage, Bio/Technology 12: 165-168.
Van Rie J. 1991. Insect control with transgenic plants: resistance proof? Trends Bioiechnol. 9: 177-179.
Vierheilig H., M. Alt, J.-M. Neuhaus, T. Boiler, A. Wiemken. 1993. Colonization of transgenic Nicotiana syivestris plants, expressing different forms of Nicotiana tabacum chitinase, by the root pathogen Khizoctonia solant and by the myeor-rhizal symbiont Glomus mosseae. Mol. Plant-Microbe Interact. 6: 261-264.
Williams S., L. Friedrich, S. Dincher, N. Carozzi, H. Kessmann, E. Ward, J. Ryals. 1992. Chemical regulation of Bacillus thuringiensis 6-endotoxin expression in transgenic plants. Bio/Technology 10: 540-543.
Zhu Q., E. A. Mäher, S. Masoud, R. A. Dixon, С J. Lamb. 1994. Enhanced protection against fungal attack by constitutive co-expression of chitinase and glucanase genes in transgenic tobacco. Bio/Technology 12: 807-812.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Предположим, что растения инфицированы вирусом без оболочки с одноцепочечным РНК-геномом (8000 нуклеотидов). Вирус и его РНК. можно легко выделить. Кроме того,
Генная инженерия растений:применение 417
у вас есть антитела ко всем четырем вирусным белкам. Какую стратегию вы выбрали бы для защиты растений от вирусной инфекции?
2. Предложите несколько стратегий создания растений, устойчивых к насекомым-вредителям.
3. Как с помощью антисмысловой РНК можно обеспечить устойчивость растений к специфическим вирусам?
4. Каким образом ингибиторы протеиназ, ингибитор амилазы и холестеролоксидаза защищают растения от насекомых-вредителей?
5. Предложите стратегию защиты растений от повреждения несколькими разными вирусами.
6. Опишите основные способы создания растений, устойчивых к гербицидам.
7. Как следует изменить растение, чтобы обеспечить его защиту от патогенных почвеных грибов?
8. Как с помощью генной инженерии получить растения, устойчивые к патогенным бактериям?
9. Какой подход вы применили бы для создания растения, толерантного к высоким концентрациям солей?
10. Предположим, что вам нужно замедлить созревание плодов авокадо при их транспортировке. Какой способ вы выберете?
11. Как с помощью методов генной инженерии получить растения с необычной окраской цветков?
12. Как с помощью генной инженерии повысить содержание лизина в сое?
13. Что такое косупрессия? Антисмысловая супрессия? Сравните их.
14. Как упростить процедуру очистки растворимых белков, например фрагментов антител, синтезируемых растениями?
ГЛАВА 19.
Трансгенные животные
Для выведения улучшенных пород домашних животных и птиц (коров с более высокой удойностью, овец с качественной шерстью, кур с более высокой яйценоскостью и т. д.) проводят множество раундов скрещиваний и отбора, каждый раз используя в качестве производителей животных с наилучшими характеристиками. В результате со временем можно получать более или менее чистые линии высокопродуктивных пород животных. Стратегия скрещивания и отбора, требующая больших временных и материальных затрат, оказалась тем не менее исключительно успешной, и сегодня почти все аспекты биологических основ выведения новых пород домашнего скота могут быть к ней сведены. Однако после того как эффективная генетическая линия получена, вводить новые признаки методом скрещивания и отбора становится все труднее. Так, линия с новым «ценным" геном может нести также и «вредные» гены, вследствие чего потомки могут оказаться менее продуктивными. Чтобы быть уверенными в том, что новая, улучшенная линия сохранит исходные полезные признаки и приобретет новые, необходимо разработать абсолютно новую стратегию.
Успешные эксперименты по введению чужеродных генов в клетки млекопитающих и возможность создания генетически идентичных животных путем переноса ядра из эмбриональной клетки в яйцеклетку с удаленным ядром (перенос ядра, клонирование) позволили включать в хромосомную ДНК высших животных отдельные функциональные гены или целые их кластеры. Используемая стратегия состоит в следующем.
• Клонированный ген вводят в ядро оплодотворенной яйцеклетки.
• Инокулированные оплодотворенные яйцеклетки имплантируют в реципиентную женскую особь (поскольку успешное завершение развития эмбриона млекопитающих в иных условиях невозможно).
• Отбирают потомков, развившихся из имплантированных яйцеклеток, которые содержат клонированный ген во всех клетках.
• Скрещивают животных, которые несут клонированный ген в клетках зародышевой линии, и получают новую генетическую линию.
Такой подход имеет много практических приложений. Например, если продукт вводимого гена стимулирует рост, то трансфицированные животные будут расти быстрее при меньшем количестве пищи. Повышение эффективности усвоения пищи всего на несколько процентов может существенно снизить стоимость конечного продукта (говядины, свинины и т. д.).
Идея генетического изменения животных путем введения генов в оплодотворенные яйцеклетки была реализована на практике в 1980-х гг. Как и во многих других новых областях науки, для упрощения обмена информацией между учеными был введен ряд новых терминов. Так, животное, чей генотип был изменен путем введения чужеродной (экзогенной) ДНК, было названо трансгенным, вводимая ДНК - трансгеном, а весь процесс -трансгенной технологией, или трансгенозом.
Эксперименты по генетической модификации многоклеточных организмов путем введения в них трансгенов требуют много времени. Тем не менее трансгеноз стал мощным инстру-
Трансгенные животные 419
| Таблица 19.1. Белковый состав (г/л) молока коров и овец | ||
| Белок | Корова | Овца |
| Казеин | ||
| aS1-Казеин | 10,0 | 12,0 |
| aS2- Казеин | 3,4 | 3.8 |
| к- Казеин | 3,9 | 4,6 |
| β- Казеин | 10,0 | 16,0 |
| Основные белки сыворотки | ||
| a-Лактальбумин | 1,0 | 0,8 |
| ß-Л актальбумин | 3,0 | 2.8 |
| Другие белки | ||
| Сывороточный альбумин | 0,4 | Не обнаружен |
| Лизоцим | Следовые количества | Не обнаружен |
| Лактоферрин | 0,1 | Не обнаружен |
| И ммуноглобулины | 0,7 | Не обнаружены |
ментом для исследования молекулярных основ экспрессии генов млекопитающих и их развития, для создания модельных систем, позволяющих изучать болезни человека, а также для генетической модификации клеток молочных желез животных с целью получения с молоком важных для медицины белков. Был даже предложен новый термин «фарминг», относящийся к процессу получения из молока трансгенных домашних ("pharm") животных аутентичных белков человека или фармацевтических препаратов. Использование молока целесообразно потому, что оно образуется в организме животного в большом количестве и его можно надаивать по мере надобности без вреда для животного. Вырабатываемый молочной железой и секретируемый в молоко новый белок не должен при этом оказывать никаких побочных эффектов на нормальные физиологические процессы, протекающие в организме трансгенного животного, и подвергаться посттрансляционным изменениям, которые по крайней мере близки к таковым в клетках человека. Кроме того, его выделение из молока, которое содержит и другие белки (табл. 19.1), не должно составлять большого труда.
Трансгенные мыши: методология
Трансгенные технологии разрабатывались и совершенствовались на лабораторных мышах. С начала 1980-х гг. в различные линии мышей были введены сотни генов. Эти исследования в значительной мере способствовали установлению механизмов генной регуляции и развития опухолей, природы иммунологической специфичности, молекулярной генетики роста и развития, других фундаментальных биологических процессов. Трансгенные мыши сыграли свою роль в исследовании возможности крупномасштабного синтеза лекарственных веществ, а также в создании трансгенных линий, позволяющих моделировать различные генетические болезни человека. Введение чужеродной ДНК мышам можно осуществить разными методами: 1) с помощью ретровирусных векторов, инфицирующих клетки эмбриона на ранних стадиях развития перед имплантацией эмбриона в самку-реципиента; 2) микроинъекцией в увеличенное ядро спермия (мужской пронуклеус) оплодотворенной яйцеклетки; 3) введением генетически модифицированных эмбриональных стволовых клеток в предимплантированный эмбрион на ранних стадиях развития.
Использование ретровирусных векторов
Преимущество метода, основанного на использовании ретровирусных векторов (рис. 19.1), перед другими методами трансгеноза состоит в его эффективности. Однако размер вставки в этом случае ограничивается 8 т. п. н., вследствие чего транс ген может оказаться лишенным прилегающих регуляторных последовательностей, необходимых для его экспрессии.
Использование ретровирусных векторов имеет и еще один большой недостаток. Хотя эти векторы создаются так, чтобы они были дефектными по репликации, геном штамма ретровируса (вируса-помощника), который необходим для получения большого количества векторной ДНК, может попасть в то же ядро, что и трансген. Несмотря на все принимаемые меры, ретровирусы-помощники могут реплицироваться в организме трансгенного животного, что совершенно недопустимо, если этих животных предполагается использовать в пищу или как инструмент для получения коммерческого продукта. И поскольку существуют альтернативные методы трансгеноза, ретровирусные векторы редко используются для создания трансгенных животных, имеющих коммерческую ценность.
420 ГЛАВА 19
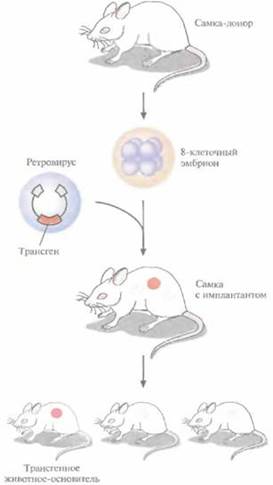 | 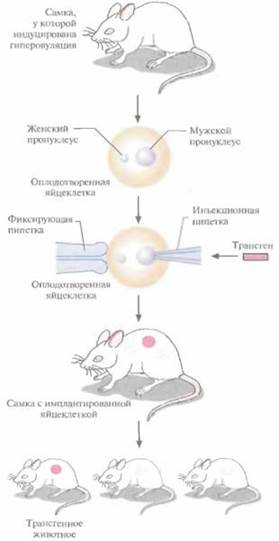 |
| Рис. 19.1. Получение линии трансгенных мышей с использованием ретровирусных векторов. Эмбрион, обычно находящийся на стадии 8 клеток, инфицируют рекомбинантным ретровирусом, несущим трансген. Самки, которым был имплантирован эмбрион («суррогатные» матери), производят на свет трансгенное потомство. Для идентификации мышат, несущих трансген в клетках зародышевой линии, проводят ряд скрещиваний. | Рис. 19.2. Получение линий трансгенных мышей методом микроинъекций. Яйцеклетки выделяют из самок-доноров, у которых была индуцирована гиперовуляция и проведено спаривание с самцами. Трансгенную конструкцию инъецируют в мужской про нуклеус оплодотворенной яйцеклетки. Яйцеклетки имплантируют в «суррогатную» мать, которая производит на свет трансгенных мышат — основателей трансгенных линий. |
Метод микроинъекции ДНК
В настоящее время для создания трансгенных мышей чаще всего используют метод микроинъекций ДНК. Он заключается в следующем (рис. 19.2).
Трансгенные животные 421
1. Увеличение числа яйцеклеток, в которых будет инъецирована чужеродная ДНК, путем стимуляции гиперовуляции у самок-доноров. Сначала самкам вводят сыворотку беременной кобылы, а спустя примерно 48 ч -хорионичеcкий гонадотропин человека. В результате гиперовуляции образуется примерно 35 яйцеклеток вместо обычных 5—10.
2. Скрещивание с самцами самок с гиперовуляцией и их умерщвление. Вымывание из яйцеводов оплодотворенных яйцеклеток.
3. Микроинъекция ДНК в оплодотворенные яйцеклетки — как правило, сразу после выделения. Часто вводимая трансгенная конструкция находится в линейной форме и не содержит прока-риотических векторных последовательностей.
У млекопитающих после проникновения сперматозоида в яйцеклетку ядро спермия (мужской пронуклеус) и ядро яйцеклетки существуют раздельно. После того как последнее заканчивает митотическое деление и становится женским пронуклеусом, может произойти слияние ядер (кариогамия). Мужской пронуклеус обычно гораздо больше женского, его легко локализовать с помощью секционного микроскопа и ввести в него чужеродную ДНК. При этом яйцеклетку на время проведения микроинъекции можно перемещать, ориентировать нужным образом и фиксировать. Опытный экспериментатор за день может инокулировать несколько сотен яйцеклеток.
После введения ДНК от 25 до 40 яйцеклеток имплантируют микрохирургическим путем в «суррогатную» мать, у которой вызывают ложную беременность скрещиванием с вазэктомированным самцом. У мышей спаривание — это единственный известный способ подготовки матки к имплантации. Поскольку вазэктомированный самец сперматозоидов не продуцирует, ни одна из яйцеклеток «суррогатной» матери не оплодотворяется. Эмбрионы развиваются только из введенных яйцеклеток, и мышата рождаются спустя примерно 3 нед после имплантации.
Для идентификации трансгенных животных выделяют ДНК из маленького кусочка хвоста и тестируют ее на наличие трансгена с помощью блот-гибридизации по Саузерну методом полимеразной цепной реакции (ПЦР). Чтобы определить, находится ли трансген в клетках зародышевой линии животного, трансгенную мышь скрещивают с другой мышью. Далее можно проводить скрещивание потомков для получения чистых (гомозиготных) трансгенных линий.
Описанный подход кажется на первый взгляд относительно простым, однако он требует четкой координации разных этапов. Даже высококвалифицированному специалисту удается получить жизнеспособных трансгенных животных в лучшем случае лишь из 5% инокулированных яйцеклеток (рис. 19.3). Ни один из этапов эксперимента не эффективен на все 100%, поэтому для микроинъекций необходимо использовать боль-
| Рис. 19.3. Суммарная эффективность трансгеноза после микроинъекций. Все оплодотворенные яйцеклетки (100%) коровы, свиньи, овцы и мыши инокулировали трансгеном, однако успешная имплантация и появление потомства были редкими событиями: трансгенное потомство давали менее 5% обработанных яйцеклеток. | 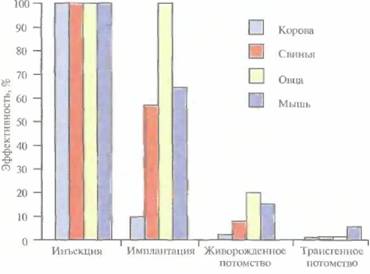 |
422 ГЛАВА 19
шое число оплодотворенных яйцеклеток. Например, при получении трансгенных мышей после инъекции ДНК выживают только 66% оплодотворенных яйцеклеток; мышата развиваются примерно из 25% имплантированных яйцеклеток, причем трансгенными из них оказываются лишь 25%. Таким образом, из 1000 имплантированных оплодотворенных яйцеклеток развивается от 30 до 50 трансгенных мышат. Кроме того, введенная ДНК может интегрировать в любое место в геноме, и зачастую множество ее копий включаются в один сайт. И наконец, не все трансгенные мышата будут обладать нужными свойствами. В организме некоторых особей трансген может не экспрессироваться из-за неподходящего окружения сайта интеграции, а в организме других число копий чужеродного гена может оказаться слишком большим, что может привести к гиперпродукции белка и нарушению нормальных физиологических процессов. И все же, несмотря на все это, метод микроинъекций используют для получения линий мышей, несущих функциональные трансгены, довольно часто.
Использование модифицированных эмбриональных стволовых клеток
Клетки, выделенные из мышиных эмбрионов на стадии бластоцисты, могут пролиферировать в культуре, сохраняя способность к дифференцировке в любые типы клеток, в том числе и в клетки зародышевой линии, при введении в другой эмбрион на стадии бластоцисты. Такие клетки называются плюрипотентными эмбриональными стволовыми клетками (ES). ES-клет-ки в культуре легко модифицировать методами генной инженерии без нарушения их плюрипотентности. Например, в определенный сайт несущественного гена в их геноме можно встроить функциональный трансген. Затем можно отобрать измененные клетки, культивировать их и использовать для получения трансгенных животных (рис. 19.4). Это позволяет избежать случайного встраивания, характерного для метода микроинъекций и ретровирусных векторных систем.
При трансфекции ES-клеток в культуре вектором, предназначенным для интеграции в специфический хромосомный сайт, в некоторых клетках ДНК встраивается случайным образом, в других встраивание происходит в нужный сайт, в большинстве же ES-клеток интеграции вообще не происходит. Для увеличения числа клеток первого типа используют так называемую позитивно-негативную селекцию. Эта стратегия состоит в позитивной селекции клеток, несущих векторную ДНК, встроившуюся в нужный сайт, и негативной селекции клеток с векторной ДНК, интегрировавшей в случайный сайт.
Сайт-мишень должен находиться в такой области геномной ДНК, которая не кодирует важных белков, чтобы интеграция чужеродной ДНК не повлияла на процессы развития или клеточные функции. Кроме того, существенно, чтобы встраивание трансгена не блокировало трансляцию соответствующего участка генома. Поиск подобных сайтов ведется непрерывно.
Вектор для позитивно-негативной селекции обычно содержит следующие элементы: 1) два блока последовательностей (НВ1 и НВ2), гомологичных отдельным участкам сайта-мишени; 2) трансген (TG), кодирующий новую функцию реципиента; 3) последовательность, кодирующую устойчивость к соединению G-418 (Neor); 4) два разных гена тимидинкиназы (tkl и tk2) вируса простого герпеса типов 1 и 2 (HSV-rit/ и HSV-Î&2) (рис. 19.5, А). Ключевым для позитивно-негативной селекции является взаимное расположение этих элементов. Трансген и ген устойчивости к G-418 (Neor) должны находиться между двумя участками ДНК, гомологичными сайту-мишени, а гены HSV-tk1 и HSV-tk2 — по бокам этой конструкции. Если встраивание происходит в случайный сайт (не в НВ1 и НВ2), то с высокой вероятностью вместе с другими последовательностями интегрируют один или оба гена HSV-/& (рис. 19.5, А). Напротив, если интеграция происходит в результате гомологичной рекомбинации путем двойного кроссинговера в нужный сайт, то в геном встроятся только трансген и ген Neor, а гены HSV-/& — нет (рис. [9.5, 5). При выращивании трансфицирован-ных клеток в присутствии G-418 клетки, не несущие ген Neor, расти не будут. Выживут только клетки, в которых произошла интеграция -иными словами, осуществляется позитивная селекция. Если одновременно с G-418 в среду
Трансгенные животные 423
| Рис. 19.4. Получение трансгенных мышей с помощью генетической модификации эмбриональных стволовых (ES) клеток. ES-клетки получают из внутренней клеточной массы бла-стоцисты мыши. Их трансфицируют вектором, несущим трансген, культивируют и идентифицируют транс-фицированные клетки методом позитивно-негативной селекции или ПЦР. Популяцию трансфицирован-ных клеток вновь культивируют и вводят в бластоцисты, которые затем имплантируют в матку «суррогатных» матерей. Скрещивая животных-основателей, несущих трансген в клетках зародышевой линии, можно получить линии трансгенных мышей. | 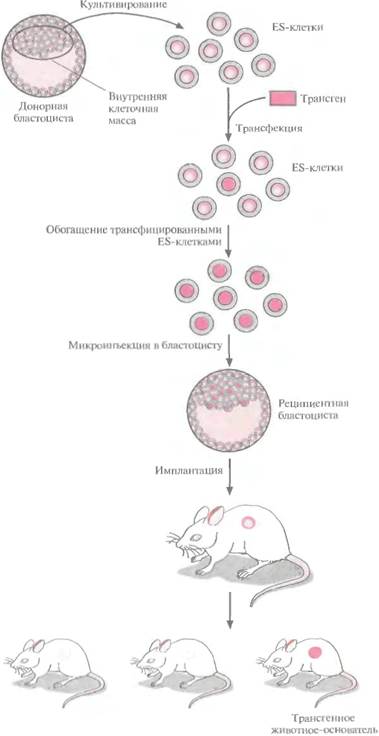 |
424 ГЛАВА 19
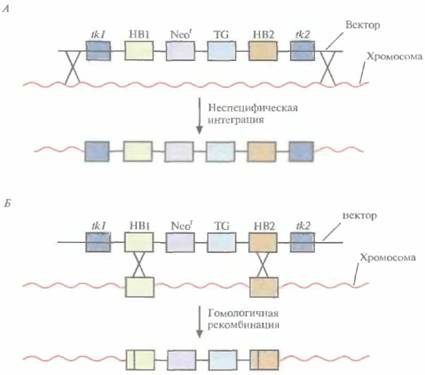 |
| Рис. 19.5. Позитивно-негативная селекция. А. Неспецифическая интеграция. В хромосому встроились оба гена тимидинкиназы (tk1 и tk2), два участка ДНК, гомологичные специфичным последовательностям хромосомной ДНК репипиентных клеток (НВ1 и НВ2), ген (Neo r), обеспечивающий устойчивость к цитотоксическому соединению G-418, и трансген (TG). После трансфекции проводят тестирование клеток на устойчивость к G-418 и ганцикловиру, который становится цититоксичным для клеток, синтезирующих тимидинкиназу. Интеграция может произойти и по-другому, со встраиванием в хромосому только гена тимидинкиназы. В присутствии G-418 и ганцикловира все такие клетки тоже погибают. Б. Специфическая интеграция с помощью гомологичной рекомбинации. В результате двойного кроссинговера между гомологичными участками (НВ1 и НВ2) векторной и хромосомной ДНК в последнюю встраивается фрагмент, не содержащий генов тимидинкиназы (tk1 и tk2). В присутствии G-418 и ганцикловира выживают только клетки, в которых прошла гомологичная рекомбинация. |
