Tobias J. W., T. E. Schrader, G. Rocap, 2 страница
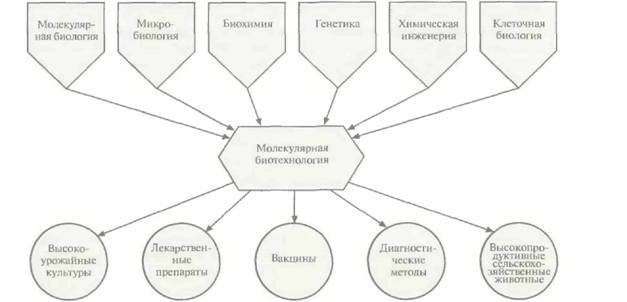 |
| Рис. 1.2. Молекулярная биотехнология использует достижения многих областей науки и позволяет создавать широкий ассортимент коммерческих продуктов и методов. |
ются другими. Но несомненно одно: в будущем молекулярная биотехнология станет рутинным методом создания живых систем, обладающих новыми функциями и возможностями.
Очень редко новые научные дисциплины возникают «на пустом месте»; как правило, их фундаментом служат различные области науки. Что касается молекулярной биотехнологии, то ее биотехнологическая составляющая относится к сфере промышленной микробиологии и химической инженерии, а молекулярная — к областям молекулярной биологии, молекулярной генетики бактерий и энзимологии нуклеиновых кислот (табл. 1.1). В широком смысле молекулярная биотехнология пользуется достижениями самых разных областей науки и применяет их для создания самых разных коммерческих продуктов (рис. 1.2).
Коммерциализация молекулярной биотехнологии
Конечной целью всех биотехнологических исследований является создание коммерческого продукта. Следовательно, молекулярная биотехнология тесно связана с экономикой. Конечно, сейчас ее развитие обусловливается не только экономическими факторами, однако на первых порах ажиотаж вокруг этой молодой науки был связан с возможностью получения прибыли. К вечеру 15 октября 1980 г. основные держатели акций фирмы Genentech стали обладателями миллионных состояний, и это побудило очень многих людей к энергичным действиям. В период 1980—1983 гг. в Соединенных Штатах было создано около 200 мелких биотехнологических компаний; этому способствовали введение налоговых льгот, высокие прибыли от операций с ценными бумагами и заинтересованность частных вкладчиков. Вслед за Гербертом Бойером, который вначале был научным сотрудником Калифорнийского университета в Сан-Франциско, а затем стал вице-президентом фирмы Genentech, многие университетские профессора открыли собственные компании.
К 1985 г. в Соединенных Штатах было уже более 400 биотехнологических фирм; многие из них включили в свое название слово «ген», чтобы заявить о принадлежности к генноинженерному «цеху»: Biogen, Amgen, Calgene, Engenics, Genex, Cangene. На сегодняшний день в США свыше 1500 биотехнологических компаний, а во
20 ГЛАВА 1
всем мире их более 3000. Кроме того, большой вклад в развитие молекулярной биотехнологии внесли все крупные международные химические и фармацевтические компании, в том числе Monsanto, Du Pont, Upjohn, American Cyanamid, Eli Lilly, SmithKline Beecham, Merck, Novartis, Hoffman-LaRoche. В период бурного развития биотехнологического бизнеса в 80-е годы мелкие компании поглощались крупными, образовывались совместные предприятия. Например, в 1991 г. 60% акций компании Genentech было продано фирме Hoffmann-LaRoche за 2,1 млрд. долларов. В то же время многие компании обанкротились. Такая мобильность — характерная особенность биотехнологической индустрии.
К середине 90-х годов на рынке появилось более десятка новых биотехнологических лекарственных препаратов, более 100 препаратов сейчас проходят клинические испытания, еще свыше 500 находятся на стадии разработки. Создано и выпущено на рынок множество новых молеку-лярно-биотехнологических продуктов, повышающих урожайность сельскохозяйственных культур и продуктивность сельскохозяйственных животных. Ежегодный доход молекулярно-био-технологической индустрии увеличился с 6 млн. долларов в 1986 г. до примерно 30 млрд. в 1996 г. По оценкам, к 2000 г. объем продаж продуктов, изготовленных с применением молекулярной биотехнологии, превысит 60 млрд. долларов в год. И хотя в целом доходность биотехнологического бизнеса оказалась не такой высокой, как ожидалось, энтузиазм инвесторов не ослабевает и свидетельствует о том, что молекулярная биотехнология — по крайней мере по их представлениям — имеет блестящие перспективы.
Все новые независимые молекулярно-био-технологические компании узкоспециализированы, что часто находит отражение в их названии. Например, вслед за компаниями, занимающимися клонированием генов, в США появились компании, выпускающие полученные генноинженерными методами антитела, которые предназначены для лечения инфекционных заболеваний, рака и других болезней человека: Immunex, ImmuLogic, ImmunoGen, Immunomedics, Medlmmune, Immune Response.
Большая часть коммерческих разработок в области молекулярной биотехнологии приходится на Соединенные Штаты. В других странах, где инвестиционный климат не столь благоприятен и бизнес менее активен, главную роль в создании молекулярно-биотехнологических предприятий играют крупные корпорации и государство. Так, правительство Японии объявило биотехнологию «стратегической индустрией» и национальным приоритетом. За дело взялись крупные японские корпорации. Вначале им не хватало собственных кадров, и первые исследования проводились в сотрудничестве с американскими университетами и компаниями. Сейчас эти корпорации приобрели необходимый опыт и сами проводят молекулярно-био-технологические разработки и создают генноинженерные продукты.
Европейская биотехнологическая индустрия тоже неуклонно развивается: к 1995 г. в странах Европы было создано более 600 биотехнологических компаний. В экономически менее развитых странах роль «локомотива» в развитии национальной молекулярно-биотехнологической индустрии взяло на себя государство. Стимулом здесь служила уверенность в том, что молекулярная биотехнология — «самая революционная из всех технологий XX века». Ни одна страна не хотела оказаться лишенной всех тех благ, которые сулило ее развитие.
Сейчас, в конце второго десятилетия своего развития, молекулярная биотехнология фактически стала одной из отраслей промышленности, хотя вначале некоторые ученые считали ее чисто эзотерическим направлением. Без сомнения, в ближайшие десять лет коммерческую молекулярную биотехнологию ожидает бурный рост, но именно поэтому давать какие-то конкретные прогнозы здесь весьма рискованно,
Надежды и опасения
С молекулярной биотехнологией человечество связывают самые большие надежды:
• возможность точной диагностики, профилактики и лечения множества инфекционных и генетических заболеваний
• значительное повышение урожайности сельскохозяйственных культур путем создания
Молекулярно-биотехнологическая революция 21
 | |
| Создание функциональных бактериальных плазмид in vitro S.N. Cohen, A.C.Y. Chang, H.W. Boyer, R.B. Helling Рroc. Natl. Acad. Sci. USA 70: 3240-3244, 1973 | |
| Отсчет истории технологии рекомбинантных ДНК ведется с работы Коэна и др., которые показали, как, объединив генетические элементы из разных источников, можно создать новую реплицирующуюся генетическую структуру. Эту структуру Коэн и др. получили из автономно существующих в бактериальной клетке внехромосомных генетических элементов, называемых плазмидам и. В своей предыдущей работе (Cohen, Chang. Proc. Natl. Acad Sci. USA 70: 1293-1297, 1973) авторы получили маленькую плазмиду из более крупной природной, отрезал от последней случайные фрагменты и вводя их смесь в клетки E. coli. Один из та-ких фрагментов размером около 1/10 размера исходной плазмиды «прижился» в бактериальной клетке как функционирующая плазми-да Чтобы исключить фактор случайности, присущий подобному подходу, и сделать процесс манипулирования генетическим материалом более управляемым, Коэн и др. решили использовать фермент (рестрицирующую эндонуклеазу), который расщепляет молекулу ДНК в строго определенном месте с образованием фрагментов с выступающими концами (липкими концами). Фрагменты разных молекул ДНК, обработанных одним и тем же ферментом, имели одинаковые липкие концы и при отжиге соединялись. Таким образом, если расщепить ДНК из равных источников одной и той же рестрицирующей эндонуклеа-зой, а затем смешать фрагменты, то образуются новые комбинированные молекулы ДНК, не существовавшие прежде. Коэн и др. не только смогли перенести ген из одной плазмиды в другую, но и показали, что этот ген остается биологически активным. К их чести, они в полной мере осознали, что данная стратегия «позволяет внедрять специфические нуклеотидные последовательности прокариотической или эукариотической хромосомы или внехромосомной ДНК в независимо реплицирующуюся бактериальную плазмиду. Другими словами, любой ген, взятый из любого организма, теоретически можно встроить в плазмиду, которая будет размножаться в клетке-хозяине, и при этом, возможно, будет синтезироваться белок, кодируемый клонированным геном. Проиллюстрировав возможность клонирования генов, Коэн и др. создали экспериментальную базу для технологии рекомбинантных ДНК, показали, что плазмиды могут служить носителями и векторами клонированных генов. Последующие работы очень скоро привели к созданию более сложных векторов и стратегий клонирования. Все это вызвало серьезную озабоченность относительно безопасности и этичности подобных экспериментов, и чтобы снять обеспокоенность общественности, были разработаны официальные инструкции и соз-даны правительственные органы, регламентирующие работы с рекомбинантными ДНК. Завершал перечень тех последствий, к которым привела публикация работы Козна и др., отметим, что она самым непосредственным образом повлияла на становление молекулярно-биотехнологической индустрии. |
растений, устойчивых к вредителям, грибковым и вирусным инфекциям и вредным воздействиям окружающей среды
• создание микроорганизмов, продуцирующих различные химические соединения, антибиотики, полимеры, аминокислоты, ферменты
• создание пород сельскохозяйственных и других животных с улучшенными наследуемыми признаками
• переработка отходов, загрязняющих окружающую среду.
Обсуждать все блага, которые нас ожидают, легко и приятно, но одновременно нельзя забывать о последствиях, к которым может привести столь бурное развитие молекулярной биотехнологии. Эта новая отрасль раскинула свои сети так широко, что общество вправе получить ответы на свои вопросы:
• не будут ли организмы, полученные методами генной инженерии, оказывать вредное воздействие на другие живые организмы или на окружающую среду?
• не приведет ли создание и распространение генетически модифицированных организмов к уменьшению природного генетического разнообразия?
• правомочно ли, используя генноинженерные методы, изменять генетическую природу человека?
22ГЛАВА I
• не нарушит ли применение новых диагностических методов прав человека на неприкосновенность частной жизни?
• следует ли патентовать животных, полученных генноинженерными методами?
• не будет ли активное финансирование молекулярной биотехнологии сдерживать развитие других важных технологий?
• не приведет ли стремление к получению максимальной прибыли к тому, что преимуществами молекулярной биотехнологии смогут воспользоваться только состоятельные люди?
• не нанесет ли молекулярная биотехнология ущерб традиционному сельскому хозяйству?
• не вытеснят ли подходы к лечению, основанные на достижениях молекулярной биотехнологии, традиционные, столь же эффективные методы лечения?
• не помешает ли борьба за приоритеты свободному обмену идеями между учеными?
Эти и многие другие вопросы рассматривают правительственные комиссии, активно обсуждают на конференциях и в научных публикациях ученые, о них глубокомысленно рассуждают авторы популярных изданий. Нa этой широчайшей основе были сформулированы соответствующие правила и инструкции, написаны руководства и выработаны политические решения. В этом принимали участие и ученые, и общественность, но некоторые противоречия все же остались.
За рекордно короткое время молекулярная биотехнология превратилась в многопрофильное научное предприятие, в равной степени коммерческое и академическое. Ей посвящено огромное количество научных и деловых публикаций, в университетах всего мира студентам и аспирантам читают учебные курсы по молекулярной биотехнологии. Об энтузиазме, с которым написан отчет Отдела по оценкам новых технологий США за 1987 г., свидетельствует следующее заявление: «Молекулярная биотехнология знаменовала собой еще одну революцию в науке, которая могла бы изменить жизнь и будущее... людей так же радикально, как это сделала Промышленная революция два века назад и компьютерная революция в наши дни. Возможность целенаправленного манипулирования генетическим материалом... обещает великие перемены в нашей жизни».
ЗАКЛЮЧЕНИЕ
В 1973 г. Стэнли Коэн и Герберт Бойер с сотрудниками разработали способ переноса генетической информации из одного организма в другой. Этот метод, получивший название технологии рекомбинантных ДНК, позволил ученым выделять конкретные гены и вводить их в организм нового хозяина. Технология рекомбинантных ДНК стимулировала развитие различных областей науки, но прежде всего она создала необходимые предпосылки для появления биотехнологии.
Биотехнология в значительной мере нацелена на получение с помощью микроорганизмов продуктов, имеющих коммерческую ценность. До эпохи рекомбинантных ДНК самым эффективным методом повышения продуктивности организмов был мутагенез с последующей селекцией оптимального штамма продуцента. Это длительный, трудоемкий, высокозатратный и небезошибочный процесс, позволяющий улучшить лишь немногие из присущих природному организму свойств. В то же время технология рекомбинантных ДНК — это быстродействующий, эффективный, мощный инструмент, обеспечивающий создание микроорганизмов с заранее заданными генетическими характеристиками. Более того, этот инструмент может работать не только с микроорганизмами, но также с растениями и животными. Союз технологии рекомбинантных ДНК и биотехнологии породил очень динамичную, исключительно интересную дисциплину — молекулярную биотехнологию.
Молекулярная биотехнология сразу захватила воображение общества. При участии частного капитала было создано много мелких компаний, занимающихся генным клонированием (технологией рекомбинантных ДНК). Правда, на то, чтобы предложить свою продукцию рынку, этим компаниям потребовалось времени несколько больше, чем ожидалось, но уже сейчас множество биотехнологических продуктов имеется в продаже и еще больше появится в ближайшем будущем.
Молекулярная биотехнология скрупулезно изучалась на предмет возможных негативных последствий ее распространения для человечества, поскольку спектр ее воздействия неограниченно широк. Рассматривались такие волнующие об-
Молекулярно-биотехнологическая революция 23
щественность вопросы, как безопасность экспериментов, негативное влияние на окружающую среду, патентование организмов, полученных генноинженерными методами.
ЛИТЕРАТУРА
Anonymous.1987. New Developments in Biotechnology— Background Paper PublicPerceptions of Biotechnology.Office of TechnologyAssessment, U.S. Congress, U.S. GovernmentPrinting Office, Washington, D.C,
Bud R. 1991. Biotechnology in the twentiethcentury. Soc, Stud.Sci.2l:415-457.
Bud R. 1993.The Uses of Lije: a Historyof Biotechnology. Cambridge University Press, Cambridge, United Kingdom,
Busch L., W.B. Lacy, J. Burkhardt, L. R, Lacy. 1992.Plants, Power, and Profit:Social, Economic and EthicalConsequences of the New Biotechnologies.Blackwell Publishers, Cambridge,Mass.
Cohen S., A.C.Y. Chang, H.W. Boyer, R.B. Helling. 1973. Constructionof biologically functional bacterial plasmids in vitro.Proc. Natl. Acad. Sei. USA 70: 3240-3244.
Davis B.[). (ed.).1991. The GeneticRevolution: Scientific Prospects and Public Perceptions. The Johns Hopkins University Press, Baltimore, Md.
Grace E.S.1997, Biotechnology Unzipped: Promises and Realities. Trifolium Press, Inc., Toronto, Canada.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Укажите недостатки метода «мутагенез и селекция» для получения имеющих коммерческую ценность организмов с улучшенными свойствами.
2. В чем состоит революционность работы Коэна, Бойера и др., опубликованной в 1973 г.?
3. Какое отношение к биотехнологии имеет Карл Эреки?
4. Опишите основные этапы биотехнологического процесса.
5. Сравните биотехнологию и молекулярную биотехнологию.
6. Какие опасения связаны с развитием молекулярной биотехнологии?
7. Раскройте смысл утверждения, что «молекулярная биотехнология является многопрофильной наукой».
8. Назовите некоторые из потенциальных возможностей, предоставляемых молекулярной биотехнологией.
9. Опишите историю развития биотехнологической индустрии за последние 30 лет.
10. Прочтите рубрику «Новости» в последних номерах журнала "Nature Biotechnology", которые вы можете найти в научной библиотеке или в Интернете (hltp://biotech.nature.com), и детально рассмотрите пару сообщений.
ГЛАВА 2.
Биологические системы, использующиеся в молекулярной биотехнологии
Объектами молекулярной биотехнологии являются самые разнообразные биологические системы: микроорганизмы, клеточные линии насекомых, растений и млекопитающих, вирусы насекомых, растений и млекопитающих, многоклеточные организмы (растения, мыши, домашние животные и т. д.) — выбор системы зависит от целей эксперимента. Характер биологической системы исключительно важен для биотехнологического процесса. Во многих случаях именно генетически модифицированная самовоспроизводящая биологическая единица — микроорганизм, вирус, растение или животное — является конечным коммерческим продуктом. Среди множества биологических объектов, использующихся в молекулярной биотехнологии, основными «рабочими лошадками» являются бактерии Escherichia coli, одноклеточные дрожжи Saccharomyces cerevisiae и различные клеточные линии животного происхождения. Все они играют важную роль в получении белков, кодируемых клонированными генами.
В последующих главах мы детально опишем различные высокоспециализированные биологические системы. В частности, в гл. 7 будет рассмотрена система «вирус насекомых—клетки насекомых", которая используется для продукции аутентичных белков, кодируемых клонированными генами, а в гл. 19 -генетическая модификация домашних животных (коров, овец, свиней). В настоящей главе мы дадим краткое описание наиболее значимых для молекулярной биотехнологии систем, которые также будут рассматриваться в последующих главах.
Прокариоты и эукариоты
Все живые организмы делятся на две основные группы: прокариоты и эукариоты. В основе этой классификации лежат многочисленные структурные различия., на которых мы остановимся более детально в последующих главах, а здесь укажем лишь основные из них: 1) наличие или отсутствие ядра, содержащего хромосомную ДНК; 2) строение и химический состав клеточной стенки и 3) наличие или отсутствие субклеточных цитоплазматических органелл. В прокариотической клетке, например бактериальной, хромосомная ДНК находится непосредственно в цитоплазме, клетка окружена ригидной клеточной стенкой, в состав которой часто входит пептидогликан, но не хитин или целлюлоза; в клетке нет субклеточных цитоплазматиче-ских органелл. В эукариотической клетке имеется ядро, отделенное от цитоплазмы ядерной мембраной, хромосомная ДНК находится в ядре; клеточная стенка, если она есть, может содержать хитин или целлюлозу, но не пептидогликан; в цитоплазме содержатся различные субклеточные органеллы (митохондрии, аппарат Гольджи, хлоропласт в клетках растений) (рис. 2.1).
Escherichia coli
Бактерия Escherichia coli — один из наиболее хорошо изученных организмов. За последние пятьдесят лет удалось получить исчерпывающую информацию о ее генетике, молекулярной биологии, биохимии, физиологии и общей биологии. Это грамотрицательная непатогенная подвижная палочка длиной менее 1 мкм. Ее средой обитания является кишечник человека, но она также может высеваться из почвы и воды. Благодаря способности размножаться простым делением на средах, содержащих только ионы Na+, K+, Mg2+, Ca2+, NH4+, Сl—, HPO42— и SO42—, микроэлементы и источник углерода (например, глюкозу), E. coli ста-
Биологические системы, использующиеся в молекулярной биотехнологии 25
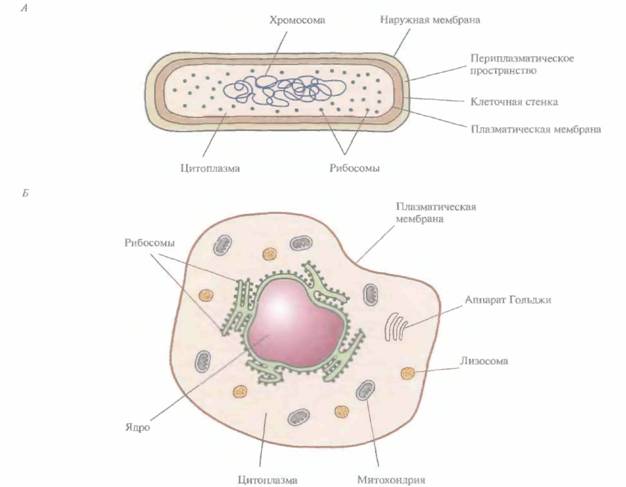 |
| Рис. 2.1. Схематическое представление прокариотической бактериальной клетки (А) и эукариотической животной клетки (Б). |
ла излюбленным объектом научных исследований. При культивировании E.coli на обогащенных жидких питательных средах, содержащих аминокислоты, витамины, соли, микроэлементы и источник углерода, время генерации (т. е. время между образованием бактерии и ее делением) в логарифмической фазе роста при температуре 37 °С составляет примерно 22 мин.
Для каждого живого организма существует определенный температурный интервал, оптимальный для его роста и размножения. При слишком высоких температурах происходит денатурация белков и разрушение других важных клеточных компонентов, что ведет к гибели клетки. При низких температурах биологические процессы существенно замедляются или останавливаются совсем вследствие структурных изменений, которые претерпевают белковые молекулы. Исходя из температурного режима, который предпочитают те или иные микроорганизмы, их можно подразделить на термофилы (от 45 до 90 °С и выше), мезофилы (от 10 до 47 °С) и психрофилы, или психротрофы (от —5 до 35 °С). Микроорганизмы, активно размножающиеся лишь в определенном диапазоне температур, могут быть полезным инструментом для решения различных биотехнологических задач. Например, термофилы часто служат источником генов, кодирующих
26ГЛАВА 2
 | ||
| Появление новых генотипов в смешанной культуре биохимических мутантов бактерий J. Lederberg, E.L. Tatum Cold Spring Harbor Symp. Quant. Biol. 11: 113-114, 1946. | ||
| Почти до середины XX в, среди бактериологов господствовало мнение, что в отличие от других живых организмов бактерии при неблагоприятных внешних воздействиях выживают не благодаря случайным генетическим изменениям (мутациям), а вследствие того, что именно эти воздействия в большинстве случаев запускают физиологические процессы, которые и позволяют бактериям выжить. Эта теория была опровергнута исследованиями С.Е. Лурия и М. Дельбрюка (Luria S. E., Delbruck M., Genetics 28: 491-51 1, 1943), которые доказали, что устойчивость Е. coli к бактериальным вирусам (бактериофагам) обусловлена именно произошедшими в них мутациями, а не реакцией бактерий на воздействие со стороны бактериофага. Эти данные нашли подтверждение в работах других авторов, изучавших последствие других неблагоприятных внешних воздействий. Исследования Лурия— Дельбрюка положили начало современной генетике микроорганизмов. | В 1946 г. Ледерберг и Татум продемонстрировали, что между членами генетически неоднородной популяции E. coli может происходить обмен генетической информацией и что при этом, как и у двуполых организмов, в результате физического обмена между хромосомами могут возникать новые генетические комбинации (генетическая рекомбинация). Обнаружение этого замечательного феномена выдвинуло E, coli на передний фронт генетических исследований. Ледерберг и Татум создали различные штаммы E. coli, индуцируя те или иные мутации и отбирая клетки с разнообразными наследуемыми дефектами метаболизма. Например, одна чистая культура могла синтезировать вещества А, В и С, но не D или E (ее обозначили ABCde). Параллельно создали другую чистую культуру, abcDE. Смешав эта культуры, получили бактерии ABCDE. Ни в одной из чистых культур тип ABCDE не возникал спонтанно. Экспериментально | исключив остальные возможные причины образования комбинации ABCDE, Ледерберг и Татум пришли к выводу, что она возникает в результате физического обмена генетическим материалом между двумя хромосомами. Другими словами, у E. coli существует некое подобие аппарата полового размножения, который, как и у других организмов, обеспечивает создание новых комбинаций генов. Как заявил Лурия, это открытие может стать «одним из наиболее великих достижений за всю историю развития бактериологии», что впоследствии и подтвердилось. Вскоре появилась целая серия блестящих работ самого Ледерберга и других авторов, которые позволили установить, как работает генетическая система E. coli. Этот микроорганизм широко использовался как модельная система для изучения молекулярных основ синтеза нуклеиновых кислот и белков, а также других важнейших биологических процессов. |
термостабильные ферменты, которые применяются в промышленных или в лабораторных процессах, а генетически видоизмененные психротрофы используют для биодеградации токсичных отходов, содержащихся в почве и воде, при пониженных температурах.
E. coli можно культивировать как в аэробных (в присутствии кислорода), так и в анаэробных (без кислорода) условиях. Однако для оптимальной продукции рекомбинантных белков E. coli и другие микроорганизмы обычно выращивают в аэробных условиях. Если целью культивирования бактерий в лаборатории является синтез и выделение определенного белка, то культуры выращивают на сложных жидких питательных средах в колбах. Для поддержания нужной температуры и обеспечения достаточной аэрации культуральной среды колбы помещают в водяную баню или термостатируемую комнату и непрерывно встряхивают. Такой аэрации достаточно для размножения клеток, но не всегда — для синтеза белка. Рост клеточной массы и продукция белка лимитируются не содержанием в питательной среде источников углерода или азота, а содержанием растворенного кислорода: при 20 °С оно равно примерно девяти миллионным долям. Это становится особенно важно при промышленном получении рекомбинантных белков с помощью микроорганизмов. Для обеспечения условий, оптимальных для максимальной продукции белков, конструируют специальные ферментеры и создают системы аэрации.
Биологические системы, использующиеся в молекулярной биотехнологии 27
Таблица 2.1. Некоторые генетически модифицированные микроорганизмы, использующиеся в биотехнологии
Acremonium chrysogenum
Bacillus brevis
Bacillus subtilis
Bacillus thuringiensis
Corynebacterium glutamicum
Erwmia herbicola
Escherichia coli
Pseudotnonas spp.
Rhizobium spp.
Streptomyces spp,
Trichoderma reesei
Xanthomonas campestris
Zymomonas mobilis
Помимо E. coli, в молекулярной биотехнологии используют множество других микроорганизмов (табл. 2.1). Их можно разделить на две группы: микроорганизмы как источники специфических генов и микроорганизмы, созданные генноинженерными методами для решения определенных задач. К специфическим генам относится, например, ген, кодирующий термостабильную ДНК-полимеразу, которая используется в широко применяемой полимеразной цепной реакции (ПЦР). Этот ген был выделен из термофильных бактерий и клонирован в E. coli. Ко второй группе микроорганизмов относятся, например, различные штаммы Corynebacterium glutamicum, которые были генетически модифицированы с целью повышения продукции промышленно важных аминокислот.
Saccharomyces cerevisiae
Дрожжи Saccharomyces cerevisiae — это непатогенные одноклеточные микроорганизмы с диаметром клетки примерно 5 мкм, которые во многих отношениях представляют собой эукариотический аналог E. coli. Их генетика, молекулярная биология и метаболизм детально изучены. S. cerevisiae размножаются почкованием и хорошо растут на такой же простой среде, как и Е. coli. Их способность к превращению сахара в этанол и углекислый газ издавна использовалась для изготовления алкогольных напитков и хлеба. В настоящее время ежегодно во всем мире расходуется более
1 млн. тонн S. cerevisiae. Дрожжи S. cerevisiae представляют также большой научный интерес. В частности, они являются наиболее удобной моделью для исследования других эукариот, в том числе человека, поскольку многие гены, ответственные за регуляцию клеточного деления S. cerevisiae, сходны с таковыми у человека. Это открытие способствовало идентификации и характеристике генов человека, отвечающих за развитие новообразований. Широко используемая генетическая система дрожжей (искусственная хромосома) является непременным участником всех исследований по изучению ДНК человека. В 19% г. была определена полная нуклеотидная последовательность всего набора хромосом S. cerevisiae, что еще более повысило ценность этого микроорганизма для научных исследований. Такая работа на эукариотах была выполнена впервые.
