Общие сведения о белках
Белки или протеины (от греческого слова protos – первый, важнейший) – важнейшие из веществ, образующих организм человека. Белки рассматриваются как носители жизни, т.к. именно они обеспечивают выполнение важнейших функций, характерных для живых организмов.
Белки отличаются от углеводов и липидов по набору входящих в их состав элементов. В состав белков входят С, Н, О, N, Р, S. В состав некоторых белков входят атомы металлов. Для белков характерно высокое содержание азота (15-18%, в среднем 16%), который хотя и входит в состав некоторых видов углеводов и липидов, но в значительно меньших количествах. Поэтому по содержание азота в различных продуктах питания судят о наличии в них белков.
Белки являются полимерными соединениями и при гидролизе распадаются на аминокислоты. В составе белков встречаются 30 различных аминокислот, из которых наиболее часто встречаются в белках 18 аминокислот. Остальные встречаются крайне редко. Кроме 18 аминокислот, в белках постоянно встречаются два амида аминокислот: амид глютаминовой кислоты и амид аспарагиновой кислоты.
Название этой группы веществ – аминокислоты - связано с наличием в составе их молекул аминной и карбоксильной групп, связанных с одним атомом углерода. Общая формула аминокислот представлена на рис. 47.
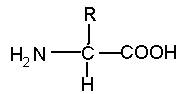
Рис. 47. Общая формула аминокислот
Различные аминокислоты отличаются строением радикала (R). Он может быть представлен атомом водорода, как в аминокислоте глицин, группой –СН3, как в аминокислоте аланин, группой –СН2ОН, как в аминокислоте серин (рис. 48). Другие аминокислоты имеют более сложное строение радикалов, в том числе и циклическое. В составе радикалов могут быть дополнительные аминные и карбоксильные группы. Именно за счет своих дополнительных карбоксильных групп аспарагиновая и глютаминовая аминокислоты могут связывать аммиак и превращаться в соответствующе амиды. 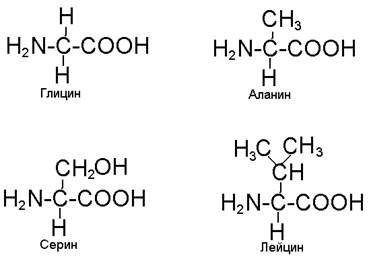
Рис.48. Структурные формулы некоторых аминокислот
Образование белков из аминокислот происходит путем взаимодействия аминной группы одной аминокислоты с карбоксильной группой другой. Уравнение реакции взаимодействия аминокислот представлено на рис. 49.
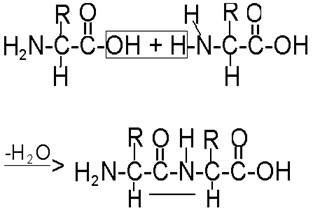
Рис. 49. Реакция соединения аминокислот с образованием пептидной связи
Химическая связь, за счет которой соединяются две аминокислоты, называется пептидной, а образовавшееся соединение - дипептид (т.е. состоящее из двух аминокислот).
У образовавшегося дипептида имеются свободные аминная и карбоксильная группы, за счет которых могут происходить реакции присоединения других аминокислот. Соединяются аминокислоты последовательно, без ветвления. В составе белковой молекулы могут содержаться десятки и сотни последовательно соединенных аминокислот. Однако, белковая молекула - это не просто длинная нить, состоящая из аминокислот. Белковые молекулы имеют достаточно сложную пространственную форму (структуру). Различают первичную, вторичную, третичную и четвертичную структуру белковых молекул.
Под первичной структурой белка понимается последовательность соединения аминокислот. Именно первичная структура белка, а точнее последовательность соединения аминокислот, определяют пространственную конфигурацию белковой молекулы (вторичную, третичную и четвертичную структуры), расположение на поверхности белковой молекулы активных групп и, в конечном итоге, возможность белковой молекулы выполнять те или иные функции.
Вторичная структура белковой молекулы. Аминокислотная цепочка на одних участках скручивается в спираль, на других принимает иную форму. Спиралевидную структуру белка принято называть α-спиралью. Ее возникновение обусловлено водородными связями между атомами водорода и кислорода, находящимися в аминокислотной цепи. Спиралевидная структура белковой молекулы характеризуется плотной упаковкой. На каждый виток спирали, закрученной слева направо, приходится 3,6 аминокислотных остатков. Радикалы аминокислот направлены наружу спирали и немного наклонены к ее началу.
Как правило, спиралевидную структуру имеет не вся протяженность аминокислотной цепи. На ее долю может приходиться от 10 до 75% и более от длины аминокислотной цепи. Остальные участки цепи могут иметь т.н. β-структуру, характеризующуюся зигзагообразной формой или иметь линейное строение.
Между радикалами, расположенными на аминокислотной спирали, возникают взаимодействия. Это приводит к тому, что белковая молекула принимает дополнительную пространственную форму – третичную структуру.
Молекулы некоторых белков состоят из нескольких субъединиц с относительно небольшой молекулярной массой, имеющих первичную, вторичную и третичную структуры. Такие белки имеют дополнительную – четвертичную структуру. Количество субъединиц в молекулах белка, имеющих четыре уровня организации, может быть различно: от двух до нескольких десятков. Наиболее часто встречаются белки, содержащие от 2 до 4 субъединиц.
Свойства белков
Белки характеризуются большим разнообразием как физических, так и химических свойств. Остановимся лишь на самых важных. Белки различаются по растворимости: одни растворяются в воде, другие в солевых растворах разной концентрации, третью не растворимы и в солевых растворах. Способность разных белков растворяться в солевых растворах разной концентрации используется при разделении различных фракций белка.
Как высокомолекулярные соединения белки при растворении образуют коллоидные растворы.
Чрезвычайная сложность структуры белковой молекулы, а также невысокая прочность связей, образующих эту структуру, делает белковые молекулы уязвимыми к различным воздействиям. Под влиянием различных воздействий пространственная структура белковых молекул может изменяться и даже разрушаться. Изменение структуры белковых молекул может происходить при изменениях температуры, рН, воздействиях некоторых ионов, других факторов. Такие структурные изменения лишают белок возможности выполнять ту или иную функцию, изменяют активность белка – фермента и т.п.
Изменение структуры белка называется денатурацией. Необратимую денатурацию может вызвать высокая температура (у различных белков разная чувствительность к изменениям температуры), ионы тяжелых металлов, радиация, сильные механические воздействия и др. При этом разрушается четвертичная, третичная и частично вторичная структура белковой молекулы.
Среди химических свойств белков следует отметить их способность вступать в реакцию гидролиза, приводящую к образованию свободных аминокислот. Вне организма гидролиз белков можно провести при кипячении в присутствии катализатора, например серной кислоты. В организме гидролиз белков происходит при участи ферментов – пептидгидролаз.
Благодаря наличию свободных аминных и карбоксильных групп, обладающих, соответственно, основными и кислотными свойствами, белки могут выполнять роль буферных систем. Это свойство белков имеет особо важное значение при выполнении интенсивной работы, когда часть образованной молочной кислоты связывается белковой буферной системой.
