Причины и механизмы развития
Причины.Причины, "запускающие" механизм ДВС крови, неоднозначны. Они включают такие факторы, как амниотическая жидкость, гемолизат эритроцитов, эллаговая кислота, ацидоз, эндотоксины, высокомолекулярные декстраны, протеолитические ферменты, АДФ, адреналин, иммунные комплексы, некоторые липидные фракции, нарушение кровотока вследствие уменьшения сердечного выброса и артериальной вазоконстрикции, дилатации капилляров и венул, увеличения вязкости крови и многие другие.
Патогенез.Многообразие ДВС-синдрома более полно раскрывают механизмы его развития. В зависимости от особенностей патогенеза выделяют следующие виды ДВС-синдрома:
▲ с преобладанием прокоагулянтного звена гемостаза;
▲ с преобладанием сосудисто-тромбоцитарного звена гемостаза;
▲с одинаковой активностью прокоагулянтного и сосудисто-тромбоцитарного звеньев.
ДВС-синдром с преобладающей активностью прокоагулянтного звена гемостаза развивается вследствие массивного поступления в кровоток прокоагулянтов: попадание в кровеносное русло тромбопластических веществ при преждевременной отслойке нормально расположенной плаценты, внутриутробной
гибели плода, эмболии околоплодными водами, метастазирующем раке, внутрисосудистом гемолизе, обширной травме, синдроме раздавливания. При этом происходит активация прежде всего внешней системы свертывания крови (см. лекцию 9). В эксперименте этот вариант ДВС воспроизводится при инфузии тромбина, тканевого тромбопластина.
ДВС-синдром с преобладающей активностью сосудисто-тромбоцитарного звена гемостаза следует рассматривать как следствие генерализованного поражения стенок сосудов и/или первичного воздействия на тромбоциты. Он встречается при различных инфекционных (вирусные, бактериальные, риккетсиозные) заболеваниях, аутоиммунных болезнях, реакции отторжения трансплантата. Предполагают, что при инфекционных заболеваниях внутрисосудистое свертывание возникает под воздействием эндотоксинов, комплексов антиген — антитело, а также в результате непосредственного повреждения эндотелия сосудов инфекционными агентами. В эксперименте этот вариант ДВС может быть показан на модели генерализованного феномена Санарелли — Шварцмана. При этом обнажаются субэндотелиальные структуры, активирующие тромбоциты и внутреннюю систему свертывания крови через контактный фактор XII (фактор Хагемана). Последний активирует калликреин-кининовую систему, фибринолиз, систему комплемента.
ДВС-синдром с одинаковой активностью прокоагулянтного и сосудисто-тромбоцитарного звеньев (формы смешанного патогенеза) сопровождает экстракорпоральное кровообращение, ожоги, острый лейкоз, болезни крови (моноклоновые парапротеинемии, эритремии, тромбоцитемии), шок.
Способствует развитию ДВС повреждение или блокада системы мононуклеарных фагоцитов, которые в норме фагоцитируют растворимые комплексы фибрина и осуществляют равновесие активных факторов свертывания.
С х е м а 15. Патогенез ДВС- синдрома
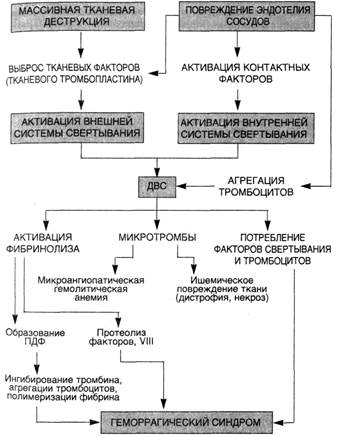
Таким образом, патогенез ДВС-синдрома сложен (схема 15): различные факторы могут либо непосредственно "запускать" ДВС (тромбопластин, большие концентрации тромбина), либо действуют через медиаторы (эндотоксин, иммунные комплексы), повреждающие эндотелий. Возникающие при этом гиперкоагуляция и тромбиногенез являются первичными процессами. Тромбин активирует противосвертывающую систему, обеспечивающую повышение защитного антикоагулянтного и фибринолитического фона. Однако массивный тромбиногенез ведет к необратимой агрегации тромбоцитов, к активации, а затем интенсивному потреблению факторов свертывания, в первую очередь VIII, V и XIII. Одновременно происходит активация фибринолитической системы с появлением в крови плазмина, способного гидролизовать или инактивировать факторы V, VIII, IX, XI. Наличие в крови активных протеиназ — тромбина и плазмина, обусловливает при ДВС как образование фибрин-мономера, так и расщепление фибриногена и фибрина с образованием продуктов деградации фибрина и фибриногена (ПДФ) — ранних продуктов X и Y и поздних D и Е. ПДФ препятствуют полимеризации фибрин-мономеров и вызывают дисфункцию тромбоцитов. Некоторые из этих фрагментов имеют высокое сродство к фибрин-мономеру и вступают с ним в комплекс, образуя так называемые комплексы растворимого фибрина, теряющего способность к полимеризации. В то же время часть фибрин-мономеров полимеризуется, создавая затруднения кровотоку в микрососудах, вызывая гипоксию тканей. Образующийся в микрососудах фибрин захватывает тромбоциты, часть из которых уже проактивирована тромбином, коллагеном или другими индукторами и секретировала тромбо-спондин, фибронектин и другие адгезивные белки. Развиваются тромбоцитопения, реакция фибрин — эритроцит и микроангиопатическая гемолитическая анемия. Микрогемолиз приводит к выделению из эритроцитов фосфолипидов и АДФ — индукторов ДВС. В этих условиях естественные защитные механизмы противосвертывающей системы истощаются или нарушаются. Дисфункция противосвертывающих механизмов, потребление факторов свертывания, ингибиторов протеиназ, особенно антитромбина III, снижение уровня фактора XIII, нарушающее стабилизацию фибрина, тромбоцитопения и высокий уровень растворимых комплексов фибрина ведут к реализации вторичного процесса — гипокоагуляции и кровотечениям.
Клинические проявления.Неоднородность ДВС-синдрома демонстрирует и разнообразие его клинических проявлений. Наиболее известными являются геморрагические проявления. Термин "тромбогеморрагический синдром" многими рассматривается как единственный эквивалент ДВС. Однако частота случаев ДВС-синдрома, протекающих с выраженной кровопотерей, не превышает 40 %. Очень часто ведущим является гипотонический компонент. Кроме геморрагии и гипотонии, ДВС-синдром может проявляться множественной недостаточностью внутренних органов. Наиболее часто вовлекаются такие органы, как" легкие (68 %), почки (66 %), печень (50 %), селезенка (52 %). Микроциркуляторные нарушения сердца и мозга могут определять различную мозговую симптоматику и нарушения ритма. Усиленное внутрисосудистое микротромбообразование может осложняться окклюзией крупных артерий, предрасположенных к этому предшествующими изменениями (в частности, атеросклеротическими).
Как видно, ДВС-синдром — понятие неоднородное: оно отражает феномен перманентного образования в организме человека микротромбов с различной степенью участия в их формировании белков-прокоагулянтов, тромбоцитов и фибринолиза (процесс формирования микротромбов может протекать с различной скоростью, степенью выраженности и полиморфными клиническими проявлениями).
Разнообразие существующих названий ДВС-синдрома отражает стремление исследователей оттенить кажущиеся им наиболее важными стороны процесса: "тромбогеморрагический синдром", "гипофибриногенемия", "гиперкоагуляционный синдром", "коагулопатия потребления", "вторичный фибринолиз", "диссеминированная внутрисосудистая коагуляция". Наиболее широким термином, охватывающим всю гамму изменений гемостаза, является "тромбогеморрагический синдром",однако и он не совсем точен, поскольку одновременное наличие тромбов и геморрагии наблюдается не всегда.
СТАДИИ ДВС-СИНДРОМА
В развитии ДВС-синдрома различают четыре стадии, каждая из которых имеет свою особую клинико-лабораторную и морфологическую характеристику.
Стадия I — гиперкоагуляция и внутрисосудистая агрегация клеток, активация других плазменных ферментных систем (например, калликреин-кининовой или системы комплемента) с развитием свертывания крови и формированием блокады микроциркуляторного русла в органах. Морфологически эта стадия характеризуется множественными микротромбами различного строения. Вариант окклюзии микроциркуляторного русла и распределение ее в органах зависят, очевидно, от этиологии, условий развития ДВС-синдрома (скорости возникновения и длительности процесса). Клинически I стадия проявляется развитием шока (при замедленном течении или умеренной тромбопластинемии часто не диагностируется).
Стадия II— коагулопатия потребления. Для нее характерны уменьшение числа тромбоцитов вследствие их агрегации, снижение содержания фибриногена, использованного на образование фибрина, расход других плазменных факторов системы регуляции агрегатного состояния крови. Эта стадия возникает на высоте гиперкоагуляции и прогрессирует до выраженной гипокоагуляции, которая проявляется кровотечениями и/или геморрагическим диатезом. Следует помнить, что эта стадия является следствием как использования факторов свертывания для образования микротромбов, так и удаления их из кровотока клетками, способными к фагоцитозу. Результаты проведенных экспериментальных исследований на ультраструктурном уровне свидетельствуют, что уже на самых ранних этапах мелкие свертки фагоцитируются клетками эндотелия сосудов и лейкоцитами. Основную роль в процессе ликвидации последствий активации системы свертывания крови играют печень и селезенка, что морфологически проявляется наличием тяжей и нитей фибрина в их синусоидах. При умеренной тромбопластинемии внутрисосудистые образования могут полностью удаляться из кровотока, и лишь наличие фибрина в фагоцитах свидетельствует о ДВС.
Стадия III— активация фибринолиза — обеспечивает полноценное восстановление проходимости сосудов микроциркуляторного русла путем лизиса микротромбов. Однако нередко активация фибринолиза принимает генерализованный характер, в результате чего лизируются не только микросвертки фибрина, но и повреждаются циркулирующие в крови факторы свертывания и фибриноген. Диагностировать морфологически III стадию довольно трудно. Высокий фибринолиз при ДВС-синдроме обусловлен появлением в крови активной протеазы — плазмина, который расщепляет фибриноген и фибрин до ранних продуктов деградации — фрагментов X и Y с высокой молекулярной массой, а затем поздних — фрагментов D и Е с меньшей молекулярной массой. Мономер фибрина легко образует растворимые комплексы как с фибриногеном, так и с продуктами распада фибриногена, теряя при этом способность полимеризоваться. Наличие растворимых комплексов мономера фибрина с продуктами распада фибриногена расценивается как свидетельство внутрисосудистого свертывания и вторичного фибринолиза. Важным светооптическим признаком этой стадии некоторые считают наличие большого количества "гиалиновых" микротромбов. Они образуются в условиях циркуляции большого количества ПДФ, что мешает образованию полноценного свертка фибрина.
Стадию IVназывают восстановительной, или стадией остаточных проявлений блокады сосудов. Для нее характерны дистрофические и некротические изменения в тканях: кортикальный некроз почек, геморрагический некроз надпочечников; некроз гипофиза, очаговый панкреонекроз, язвенный энтероколит. Клинические признаки этой стадии зависят от выраженности нарушений микроциркуляции и от степени повреждения паренхимы и стромы в том или ином органе. При благоприятном течении синдрома эта стадия завершается выздоровлением, при неблагоприятном — развитием органной недостаточности: острой легочной, почечной, печеночной, надпочечниковой.
