Основной список (из задачника) – 2006 год
| № 1.1 Концентрация 2,3-бисфосфоглицерата в эритроцитах при хранении консервированной крови может уменьшаться с 8,0 до 0,5 ммоль/л. Можно ли переливать такую кровь тяжелобольным людям, если концентрации 2,3-бисфосфоглицерата восстанавливается не ранее чем через 3 суток? Для ответа поясните: а) Что такое 2,3-бисфоглицерат б) Когда и в каком участке он присоединяется к гемоглобину в) Как изменяется сродство гемоглобина к О2 при присоединении 2,3-бисфосфоглицерата. Кровь со сниженной концентрацией 2,3-БФГ нельзя переливать тяжелобольным людям, так как 2,3-БФГ необходим для снабжения тканей кислородом, а его концентрация восстанавливается не ранее, чем через 3 суток. а) 2,3-бисфосфоглицерат (2,3-БФГ) – вещество, синтезируемое из промежуточного продукта окисления глюкозы – 1,3-бисфосфоглицерата. б) В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров. Центральная полость – место присоединения БФГ. В молекуле дезоксигемоглобина по сравнению с оксигемоглобином есть дополнительные ионные связи, соединяющие протомеры, поэтому размеры центральной полости больше в дезоксигемоглобине, следовательно 2,3-БФГ может присоединиться только к дезоксигемолглобину. В тканях 2,3-БФГ присоединяется к дзоксигемоглобину и снижает сродство гемоглобина к кислороду. лёгкие в) HbO2 + 2,3-БФГ ↔ Hb*2,3-БФГ + O2 ткани В результате взаимодействия 2,3-БФГ с дезоксигемоглобином образуется 5 дополнительных ионных связей, что снижает сродство гемоглобина в кислороду. | № 1.2 Существует наследственное заболевание, связанное с изменением концентрации 2,3-бисфосфоглицерата в эритроцитах. Это вещество синтезируется из 1,3-бисфосфоглицерата при участии мутазы. Какое значение имеет 2,3-бисфосфоглицерат в регуляции сродства гемоглобина к О2? Для ответа на вопрос: а) Укажите, в каком метаболическом пути синтезируется предшественник 2,3-бисфосфоглицерата. Напишите схему этого пути, подчеркните субстрат, используемый для синтеза 2,3-бисфосфоглицерата б) Объясните, каков механизм регуляции сродства гемоглобина к О2 с помощью 2,3-бисфосфоглицерата в) Уточните, как изменится количество доставляемого в ткани О2 при снижении синтеза 2,3-бисфосфоглицерата. В тканях 2,3-БФГ присоединяется к дезоксигемоглобину и снижает сродство гемоглобина к кислороду. а) Предшедственник 2,3-БФГ – 1,3-БФГ – синтезируется в гликолизе. 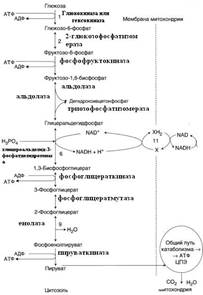 Субстрат – 1,3-бисфосфоглицерат. лёгкие б) HbO2 + 2,3-БФГ ↔ Hb*2,3-БФГ + O2 ткани В результате взаимодействия 2,3-БФГ с дезоксигемоглобином образуется 5 дополнительных ионных связей, что снижает сродство гемоглобина в кислороду. Центральная полость дезоксигемоглобина является местом присоединения 2,3-БФГ. 2,3-БФГ может присоединяться только к дезоксигемоглобину, так как центральная полость дезоксигемоглобина больше, чем оксигемоглобина за счёт дополнительных ионных связей. в) При снижении синтеза 2,3-БФГ количество доставляемого в ткани кислорода снизится. Субстрат – 1,3-бисфосфоглицерат. лёгкие б) HbO2 + 2,3-БФГ ↔ Hb*2,3-БФГ + O2 ткани В результате взаимодействия 2,3-БФГ с дезоксигемоглобином образуется 5 дополнительных ионных связей, что снижает сродство гемоглобина в кислороду. Центральная полость дезоксигемоглобина является местом присоединения 2,3-БФГ. 2,3-БФГ может присоединяться только к дезоксигемоглобину, так как центральная полость дезоксигемоглобина больше, чем оксигемоглобина за счёт дополнительных ионных связей. в) При снижении синтеза 2,3-БФГ количество доставляемого в ткани кислорода снизится. | № 1.3 Кислород необходим клеткам для процессов окисления веществ и получения энергии. Недостаток кислорода, так же как его избыток, губителен для тканей. Каким образом регулируется количество О2, доставляемого в ткани в соответствии с потребностями клеток в кислороде? При ответе объясните: а) Что такое эффект Бора б) Как связан этот эффект с метаболической активностью тканей; приведите примеры реакций, в которых выделяется СО2 в) Как изменится количество поступающего в ткани О2 при алкалозе а) На связывание кислорода гемоглобином сильное влияние оказывает pH и CO2. Связывание CO2 и H+ снижает способность гемоглобина связывать O2. В периферических тканях, с относительно низким значением pH и высокой CO2, сродство Hb к кислороду падает по мере связывания CO2 и H+. В лёгочных капиллярах выделяется CO2 и соответственно увеличивается pH крови, что приводит к увеличению сродства Hb к O2. Влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином называется Эффектом Бора. Hb + O2 ↔ HbO2 Ионная форма реакции объясняет влияние концентрации H+ на связывание O2 Hb-ион. HHb+ + O2 ↔ HbO2 + H+ Уменьшение pH и увеличение H+ приводит к высвобождению O2 из HbO2. б) 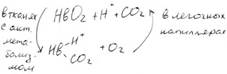 в)Алкалоз – увеличение CO2. При увеличении CO2 сродство Hb к кислороду падает, следовательно, количество кислорода, поступающего в ткани, увеличится. Ацидоз – увеличение H+ Увеличение H+ способствует освобождению кислорода, а увеличение кислорода стимулирует высвобождение H+ в)Алкалоз – увеличение CO2. При увеличении CO2 сродство Hb к кислороду падает, следовательно, количество кислорода, поступающего в ткани, увеличится. Ацидоз – увеличение H+ Увеличение H+ способствует освобождению кислорода, а увеличение кислорода стимулирует высвобождение H+ | |
| № 1.4 В крови студента одной из африканских стран, поступившего в больницу по поводу одышки, головокружения, учащенного сердцебиения и болей в конечностях, при анализе крови были найдены эритроциты, имеющие форму серпа. Объясните причину развития данного заболевания. Для ответа на этот вопрос объясните: а) Какое строение имеет гемоглобин А б) Какие изменения в структуре белка привели к образованию патологической формы гемоглобина в) Как называется такая форма гемоглобина г) Почему изменяются форма и функция эритроцитов. Заболевание – серповидноклеточная анемия. а) Гемоглобин А состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем. β-цепь Вал-Гли-Лей-Тре-Про-Глу-Глу-Лиз б) В гемоглобине S мутантными оказались 2β-цепи, в которых Глу, высокомолекулярная отрицательно заряженная аминокислота в положении 6, была заменена Вал, содержащим гидрофобный радикал. HbS 2β-цепь Вал-Гли-Лей-Тре-Про-Вал-Глу-Лиз в) Гемоглобин S г) В дезоксигемоглобине S имеется участок, комплиментраный другому участку таких же молекул, содержащему изменённую. В результате молекулы дезоксигемоглобина начинают слипаться, образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа. Нарушение доставки кислорода в ткани вызывает боли и даже некроз клеток в данной области. | № 2.1 У мужчины, который использовал инсектицид хлорофос для уничтожения колорадского жука на листьях картофеля, появились признаки отравления: головная боль, тошнота, и галлюцинации. Известно, что хлорофос является фосфоорганическим соединением. Опишите механизм действия фторфосфатов и объясните, почему хлорофос токсичен. Для этого: а) Объясните, активность какого фермента в крови изменяется при отравлении этим инсектицидом; укажите механизм его действия б) Напишите реакцию, скорость которой изменяет хлорофос. а) Органические фторфосфаты типа диизопропилфторфосфата (ДФФ) являются ядами, потому что ковалентно связываются с остатком серина в активном центре ферментов, которые используют остаток серина для гидролитического расщепления. Симптомы отравления органическими фторфосфатами связаны в основном с необратимым ингибированием фермента – ацетилхолинэстеразы (АХЭ) Ацетилхолинэстераза ускоряет гидролиз ацетилхолина, функционирующего в качестве нейромедиатора. Продукты распада ацетилхолина – ацетат и холин – не способны действовать как нейромедиаторы. Увеличение количества ацетилхолина в синаптической щели при ингибировании АХЭ приводит к стойкой деполяризации постсинаптической мембраны и может вызвать паралич. ДФФ и подобные фторфосфаты образуют ковалентную связь с остатком серина в активном центре АХЭ. Ингибирование является необратимым, и активность АХЭ восстанавливается только после синтеза новых молекул фермента. б)  | № 2.2 Несколько лет назад в токийском метро террористы распылили одно из самых сильных отравляющих веществ – зарин. Многие пассажиры потеряли сознание, некоторые умерли в результате остановки дыхания. На чем основано нервно-паралитическое действие зарина? а) Активность какого фермента и как изменится в крови при отравлении этим веществом б) Напишите реакцию, скорость которой изменяет зарин. а) Органические фторфосфаты типа диизопропилфторфосфата (ДФФ) являются ядами, потому что ковалентно связываются с остатком серина в активном центре ферментов, которые используют остаток серина для гидролитического расщепления. Симптомы отравления органическими фторфосфатами связаны в основном с необратимым ингибированием фермента – ацетилхолинэстеразы (АХЭ) Ацетилхолинэстераза ускоряет гидролиз ацетилхолина, функционирующего в качестве нейромедиатора. Продукты распада ацетилхолина – ацетат и холин – не способны действовать как нейромедиаторы. Увеличение количества ацетилхолина в синаптической щели при ингибировании АХЭ приводит к стойкой деполяризации постсинаптической мембраны и может вызвать паралич. ДФФ и подобные фторфосфаты образуют ковалентную связь с остатком серина в активном центре АХЭ. Ингибирование является необратимым, и активность АХЭ восстанавливается только после синтеза новых молекул фермента. б)  |
№ 2.3 Для лечения двигательных нарушений после травм, параличей, полиомелита используют препарат калимин, который по структуре похож на ацетилхолин. Как изменится концентрация ацетилхолина в нервно-мышечных синапсах после поступления нервного импульса при лечении калимином? Для ответа на вопрос: а) Опишите влияние структурных аналогов субстратов на активность ферментов б) Напишите реакцию гидролиза ацетилхолина и объясните ее значение для проведения нервного импульса. После поступления нервного импульса при лечении калимином концентрация ацетилхолина увеличится. а) Использование структурных аналогов является конкурентным ингибированием. В результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. С ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплекс фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. E + S → ES → E + P E + I → EI б)  Калимин является структурным аналогом ацетилхолина и ингибирует ацетилхолинэстеразу (АХЭ), катализирующую реакцию гидролиза ацетилхолина. При добавлении ингибиторов активность ацетилхолина увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы использую при лечении мышечных дистрофий. Холин и уксусная кислота не способны действовать как нейромедиаторы. Калимин является структурным аналогом ацетилхолина и ингибирует ацетилхолинэстеразу (АХЭ), катализирующую реакцию гидролиза ацетилхолина. При добавлении ингибиторов активность ацетилхолина увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы использую при лечении мышечных дистрофий. Холин и уксусная кислота не способны действовать как нейромедиаторы. | № 2.4 Объясните, почему протеолитические ферменты и дезоксирибонуклеаза используются для лечения гнойных ран: а) Какие реакции катализируют эти ферменты б) Как изменится вязкость гнойного содержимого, если она зависит от концентрации макромолекул в его составе в) Можно ли для очищения ран от гноя использовать пепсин, а также коллагеназу и гиалуронидазу. а) Протеолитические ферменты расщепляют пептидные связи, образованные определёнными аминокислотами. К протеолитическим ферментам относятся пепсин, трипсин, химотрипсин. Пепсин, химотрипсин, трипсин являются эндопептидазами, то есть действуют на пептидные связи, удалённые от концов пептидной цепи. Дезоксирибонуклеаза (ДНК-аза) и рибонуклеаза (РНК-аза) панкреатического сока принимают участие в расщеплении нуклеиновых кислот. Они являются эндонуклеазами и гидролизуют макромолекулы до олигонуклеотидов. б) Так как вязкость гнойного содержимого зависит от концентрации макромолекул в его составе, значит при дейсвтии протеолитических ферментов и ДНК-азы вязкость уменьшится. в) Пепсин не используется для лечения гнойных ран, так как оптимум pH пепсина равен 1,0-2,5, что соответствует pH желудка, поэтому пепсин используется в зместительной энзимотерапии при ахимии, гипо- и -анацидных гастритах. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей (pH ~7,0). Ферментные препараты РНК-азу и ДНК-азу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов. Гиалуронидазу нельзя использовать для очищения ран от гноя. Она разрушает полисахаридные цепи. Из внеклеточного пространства гликозаминогликаны поступают в клетку по механизму эндоцитоза и заключаются в эндоцитозные пузырьки, которые затем сливаются с лизосомами. Лизосомальные гидролазы обеспечивают постепенное полное расщепление гликозаминогликанов до мономеров. В результате микроорганизмы попадают в межклеточное вещество, а затем в ткани организма, что приводит к гнойной инфекции. Гиалуронидаза используется для рассасывания рубцов подкожно и внутримышечно. Коллагеназа используется в медицинской практике для лечения ожоговой болезни в хирургии и для лечения гнойных заболеваний глаз в офтальмологии. Существует два типа коллагеназ: 1. Тканевая коллагеназа участвует в катаболизме коллагена. 2. Бактериальная коллагеназа синтезируется некоторыми микроорганизмами. Расщепляет пептидную цепь коллагена более чем в 200 местах. Разрушаются соединительнотканные барьеры в организме человека, что обеспечивает инвазию микроорганизма и способствует возникновению и развитию газовой гангрены. Сам возбудитель не содержит коллагена и, поэтому не подвержен действию коллагеназы. | № 2.5 На чем основано действие аспирина как жаропонижающего средства, лекарства, снимающего слабые боли и уменьшающего воспалительные процессы? а) Напишите схему процесса, на который влияет аспирин б) Укажите фермент, ингибитором которого является аспирин в) В чем заключается причина изменения конформации молекул фермента при действии на нее аспирина, обратима ли инактивация фермента. а) Аспирин является необратимым ингибитором синтеза эйкозаноидов. 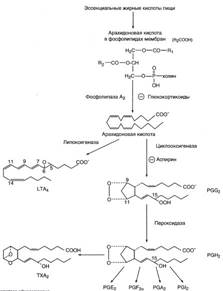 При развитии воспалительных процессов увеличивается синтез большинства эйкозаноидов. Эйкозаноиды – гормоны местного действия, вызывающие эффект по паракринному или аутокринному механизму через специфические рецепторы. Эйкозаноиды образуются во всех органах и тканях, а не в эндокринных железах б) Аспирин является ингибитором циклооксигеназы.в в) Ацетильный остаток переносится с молекулы аспирина на ОН-группу фермента и необратимо ингибирует его. При развитии воспалительных процессов увеличивается синтез большинства эйкозаноидов. Эйкозаноиды – гормоны местного действия, вызывающие эффект по паракринному или аутокринному механизму через специфические рецепторы. Эйкозаноиды образуются во всех органах и тканях, а не в эндокринных железах б) Аспирин является ингибитором циклооксигеназы.в в) Ацетильный остаток переносится с молекулы аспирина на ОН-группу фермента и необратимо ингибирует его. 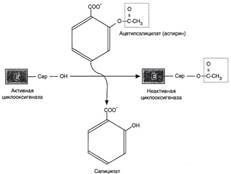 |
| № 2.6 Каптоприл – лекарственный препарат, конкурентный ингибитор карбоксидипептидилпептидазы. Напишите схематически реакцию, скорость которой уменьшает каптоприол, и объясните: а) Концентрация какого вещества при этом уменьшается в крови б) Почему это лекарство эффективно при некоторых формах гипертонической болезни а) Концентрация ангиотензина-II б) Капторприл – конкурентный ингибитор карбоксипептидазы, который ингибирует синтез ангиотензина-II. Ди- и -трипептидазы синтезируются в активной форме в клетках слизистой кишечника, где расщепляют ди- и -трипептидазы до аминокислот, причём дипептидазы действуют только на дипептиды. | № 2.7 Обнаружено, что увеличение концентрации цАМФ облегчает состояние больных бронхиальной астмой. Укажите от активности каких ферментов зависит концентрация цАМФ в клетке, и ингибиторы какого из этих ферментов можно использовать в качестве лекарств для облегчения симптомов этой болезни? Для ответа на вопрос: а) Напишите схему реакции, которая ускоряет ферментом, снижающим концентрацию цАМФ б) Какое значение для клетки имеет этот фермент, и какой гормон в клетке является его активатором. От активности аденилатциклазы и фосфодиэстеразы. Ингибиторы фосфодиэстеразы. а)Фермент фосфодиэстераза 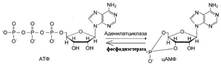 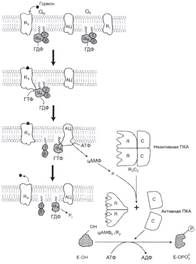 б)ФДЭ – фосфодиэстераза индуцируется в печени инсулином. цАМФ активируеть ПКА (протеинкиназу А), которая: 1. Активирует ТАГ-липазу, которая участвует в мобилизации жира 2. Инактивирует гликогенсинтетазу и активирует гликофосфорилазу. В результате глюкоза поступает в кровь. б)ФДЭ – фосфодиэстераза индуцируется в печени инсулином. цАМФ активируеть ПКА (протеинкиназу А), которая: 1. Активирует ТАГ-липазу, которая участвует в мобилизации жира 2. Инактивирует гликогенсинтетазу и активирует гликофосфорилазу. В результате глюкоза поступает в кровь. | № 2.8 При длительном приеме антибиотиков и сульфаниламидов происходит угнетение микрофлоры кишечника, участвующей в синтезе пиридоксина. Скорость каких реакций в клетках уменьшится и почему? а) Напишите несколько реакций, для протекания которых необходим пиридоксин б) Какое значение имеют эти реакции для организма человека? а) Пиридаксин (витамин B6) является витамином0предшественником ПФ (пиридоксальфосфата). ПФ участвует в трансаминировании и декарбоксилировании аминокислот. Также ПФ входит в состав гликогенфосфорилазы. Трансаминированию подвергаются все аминокислоты кроме Лиз, Тре, Про.  Декарбоксилирование в синтезе биогенных аминов (нейромедиаторов) Декарбоксилирование в синтезе биогенных аминов (нейромедиаторов) 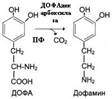 б) Значение реакций трансаминирования: 1. Первая реакция на пути катаболизма большинства аминокислот 2. Последняя реакция на пути синтеза заменимых аминокислот 3. Таким образом происходит перераспределение азота между аминокислотами. Значение реакций декарбоксилирования: Причиной паркинсонизма является недостаточность дофамина в чёрной субстанции мозга. Это может быть вызвано снижением активности тирозингидроксилазы и ДОФА-декарбоксилазы. б) Значение реакций трансаминирования: 1. Первая реакция на пути катаболизма большинства аминокислот 2. Последняя реакция на пути синтеза заменимых аминокислот 3. Таким образом происходит перераспределение азота между аминокислотами. Значение реакций декарбоксилирования: Причиной паркинсонизма является недостаточность дофамина в чёрной субстанции мозга. Это может быть вызвано снижением активности тирозингидроксилазы и ДОФА-декарбоксилазы. | |
№ 3.1 Весной у многих людей развивается гиповитаминоз, обусловленный снижением в пище количества витаминов В1, В2, РР. Наиболее характерными признаками этих гиповитаминозов являются сонливость и повышенная утомляемость. а) Почему дефицит витамина РР может привести к таким состояниям б) Для объяснения представьте схемы метаболических путей, в которых принимает участие витамин РР в) Почему дефицит витамина В2 может привести к описанным состояниям г) Для объяснения представьте схемы метаболических путей, в которых принимает участие витамин В2 д) Почему дефицит витамина В1 может привести к таким состояниям? Представьте схемы метаболических путей, для которых необходим витамин В1 е) Для объяснения представьте схемы метаболических путей, в которых принимает участие витамин В1. а), б) Витамин PP – предшественник кофермента NAD+, который участвует в 1. Функционировании ПДК (пируватдегидрогеназного комплекса) 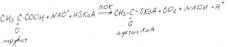 2. ЦТК (Цикл Кребса) (Изоцитрат → α-КГ; α-КГ-сукцинил-КоА; сукцинат → фумарат) 2. ЦТК (Цикл Кребса) (Изоцитрат → α-КГ; α-КГ-сукцинил-КоА; сукцинат → фумарат) 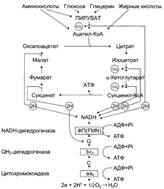 в), г) Витамин B2 – предшественник FAD, который участвует в ЦТК д), е) Витамин B1 – предшественник FMN, который участвует в ЦПЭ (цепь переноса электронов) в), г) Витамин B2 – предшественник FAD, который участвует в ЦТК д), е) Витамин B1 – предшественник FMN, который участвует в ЦПЭ (цепь переноса электронов) 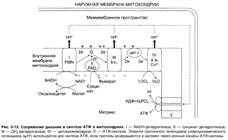 | № 4.1 В клетке имеется несколько десятков различных тРНК и несколько десятков тысяч мРНК. Чем объяснить такое различие в количестве разных типов нуклеиновых кислот? Для ответа на этот вопрос: а) Объясните, как это различие связано с функциями молекул в клетках эукариотов б) Иллюстрируйте объяснение схемами, отражающими участие этих молекул в реализации генетической информации. Так как мРНК кодирует огромное количество белков, а тРНК всего 20 основных аминокислот, это и обуслвливает различие. а)тРНК – адапторная молекула, одним концом взаимодействует с аминокислотой, а другим с антикодоном - кодоном мРНК. мРНК – матрица, содержащая линейную последовательность кодонов, определяющих первичную структуру белка. б) Активация тРНК  Инициация. Инициация. 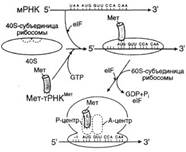 Элонгация. Элонгация. 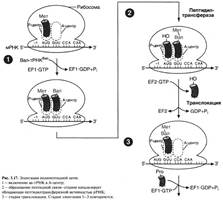 Терминация Терминация 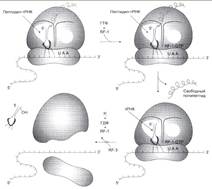 | № 4.2 Если повреждения структуры ДНК не репарируются, то они могут быть летальными для клетки. Будут ли приводить к столь же тяжелым последствиям повреждения молекулы РНК? Ответ поясните, сравнив строение и функции этих нуклеиновых кислот у эукариотов. Структура ДНК и РНК – способ записи информации, который обеспечивает формирование в организме двух информационных потоков. Один из потоков осуществляет воспроизведение информации, заключённой в молекуле ДНК – удвоение молекулы ДНК – репликация. 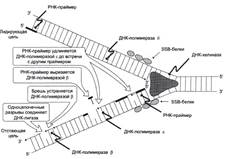 Дргуой поток информации реализуется в процессе жизнедеятельности клетки. Происходит считывание или транскрипция генов в форме полинуклеотидных последовательностей мРНК Дргуой поток информации реализуется в процессе жизнедеятельности клетки. Происходит считывание или транскрипция генов в форме полинуклеотидных последовательностей мРНК 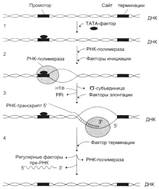 и использование их в качестве матрицы для синтеза соответствующих белков – трансляция. Инициация. и использование их в качестве матрицы для синтеза соответствующих белков – трансляция. Инициация. 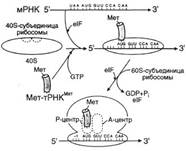 Элонгация. Элонгация. 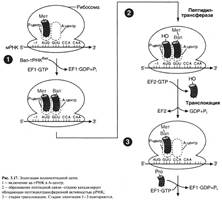 Схему терминации Схему терминации 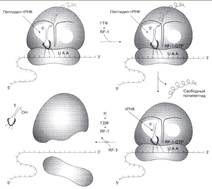 | |
№ 4.3 Под действием ионизирующей радиации в молекуле ДНК оказались отщепленными два азотистых основания из комплементарной пары А-Т. Может ли система, обеспечивающая стабильность генетического материала, устранить это повреждение в половых клетках? При ответе на вопрос: а) Изобразите схему процесса, участвующего в исправлении повреждений ДНК б) Укажите, как снижение активности этого процесса может отразиться на функции генома а)Исправление повреждений ДНК – репарация  б) Репарация возможна благодаря существованию 2-х копий генетической информации. Репарация необходима для сохранения генетического материала не протяжении всей жизни организма (сохранение структурных генома). Все ферменты постоянно активны, то есть процесс идёт непрерывно. Снижение актвиности ферментов репарации приводит к накоплению повреждений (мутаций) в ДНК, что может привести к летальному исходу. б) Репарация возможна благодаря существованию 2-х копий генетической информации. Репарация необходима для сохранения генетического материала не протяжении всей жизни организма (сохранение структурных генома). Все ферменты постоянно активны, то есть процесс идёт непрерывно. Снижение актвиности ферментов репарации приводит к накоплению повреждений (мутаций) в ДНК, что может привести к летальному исходу. 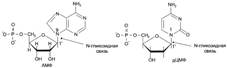 | № 4.4 После облучения ультрафиолетовыми лучами у пациента в ДНК фибробластов кожи обнаружено большое количество димеров тимина. В норме такие изменения ДНК обнаруживаются едко. Чем можно объяснить появление повреждений в ДНК данного пациента? Для ответа на этот вопрос: а) Укажите, почему этот тип нарушений в молекуле ДНК в норме обнаруживается редко б) Опишите процесс, обеспечивающий удаление димеров тимина в) Перечислите повреждения ДНК, которые могут устраняться с помощью этого процесса Под действием УФО двойная связь между C5 и С6 атомами углерода в составе пиримидиновых оснований (тимина и урацила) может разрываться. Атомы углерода остаются связанными одной связью Расстояние между ними позволяет освободившимся валентностям между C-C атомами пиримидиновых оснований, расположенных последовательно, сформировать циклобутановое кольцо. а) Потому что работает репарация.  б) Удаление пиримидиновых димеров Тимина происходит под действием фотолиазы. Фермент расщепляет вновь образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. в)Замена нуклеотида, вставка, делеция. Процессы, при которых остаётся неповреждённая вторая цепь, чтобы на ней, как на матрице достроить повреждённую цепь. б) Удаление пиримидиновых димеров Тимина происходит под действием фотолиазы. Фермент расщепляет вновь образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. в)Замена нуклеотида, вставка, делеция. Процессы, при которых остаётся неповреждённая вторая цепь, чтобы на ней, как на матрице достроить повреждённую цепь. | № 4.5 В парафолликулярных клетках щитовидной железы в ходе транскрипции гена кальцитонина и последующих ковалентных модификаций образуется мРНК, участвующая в синтезе гормона кальцитонина. В головном мозге из того же первичного транскрипта после посттранскрипционных модификаций формируется мРНК, участвующая в синтезе белка, ответственного за вкусовое восприятие. Каким образом из одного и того же первичного транскрипта возможно образование разных “зрелых” мРНК? Для ответа на этот вопрос: а) Изобразите схему “созревания” мРНК в ходе ковалентных модификаций б) Объясните, почему в разных тканях первичный транскрипт может превращаться в мРНК, содержащие информацию о белках, имеющих в полипептидной цепи гомологичные участки, но выполняющих разные функции. а) 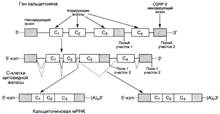 б)В альтернативном сплайсинге из одного и того же первичного транскрипта можно по-разному вырезать интроны. И в результате мы получаем несколmrj зрелых мРНК, имеющих как гомологичные участки, так и негомологичные. Тоже касается белков, которые будут образовываться на этих мРНК: они будут содержать участки с одинаковыми аминокислотными последовательностями и с неодинаковыми. б)В альтернативном сплайсинге из одного и того же первичного транскрипта можно по-разному вырезать интроны. И в результате мы получаем несколmrj зрелых мРНК, имеющих как гомологичные участки, так и негомологичные. Тоже касается белков, которые будут образовываться на этих мРНК: они будут содержать участки с одинаковыми аминокислотными последовательностями и с неодинаковыми. | |
№ 4.6 У больного с повышенной концентрацией фенилаланина (Фен) в крови установлена нормальная структура фермента фенилаланингидроксилазы. Дальнейшее обследование позволило выявить мутацию по типу замены нуклеотида в гене фермента дигидробиоптеринредуктазы. Объясните, почему мутация по типу замены нуклеотида в гене этого фермента может стать причиной фенилкетонурии. Для этого: а) Напишите реакцию метаболизма Фен, которая идет при участии дигидробиоптеринредуктазы б) Укажите, метаболизм каких аминокислот, помимо Фен, будет нарушен при данной патологии. а) 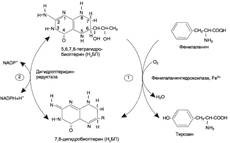 Фенилкетонурия – наследственное заболевание, связанное с нарушением фермента фенилаланилгидроксилазы (классическая фенилкетонурия) или с нарушением перехода H4БП ↔ H2БП (вариантная фенилкетонурия) Регенерация H2БП происходит при участии дигидробиоптеринредуктазы с использованием NADPH + H+ б) Тирозин, серотонин Фенилкетонурия – наследственное заболевание, связанное с нарушением фермента фенилаланилгидроксилазы (классическая фенилкетонурия) или с нарушением перехода H4БП ↔ H2БП (вариантная фенилкетонурия) Регенерация H2БП происходит при участии дигидробиоптеринредуктазы с использованием NADPH + H+ б) Тирозин, серотонин | № 4.7 В яйцеклетке в смысловой части гена, кодирующего строение фермента диоксигеназы гомогентизиновой кислоты, произошла замена 7-го нуклеотида с образованием терминирующего кодона. Какие изменения в структуре фермента произойдут в ходе трансляции мутантного белка? Для ответа на этот вопрос: а) Изобразите схему синтеза белка на рибосоме и покажите, какой продукт будет образовываться в ходе трансляции мутантной мРНК б) Вспомните, в каком процессе участвует диоксигеназа гомогентизиновой кислоты и к каким фенотипическим проявлениям приведет эта мутация. Синтезируется неактивный фермент. а) Инициация. 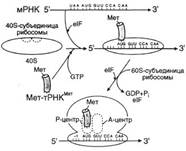 Элонгация. Элонгация. 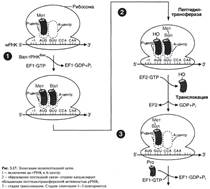 Терминация Терминация 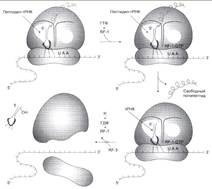 б)Метаболизм тирозина в печени. Проявления – заболевание алкаптонурия. б)Метаболизм тирозина в печени. Проявления – заболевание алкаптонурия. | № 4.8 Первичная структура мРНК кодирует только одну последовательность аминокислот в белке. Можно ли, исходя из строения белкового гормона глюкагона (29 аминокислот), предсказать нуклеотидную последовательность мРНК, кодирующую этот белок? Для обоснования ответа вспомните свойства генетического кода и, используйте N-концевой участок молекулы гормона H2N-Гис-Сер-Гли-……, объясните способ кодирования белков в молекулах ДК и РНК. Строение мРНК мы представить не сможем, так как генетический код вырожден. H2N-Гис-Сер-Гли-…… Гис - CAU Сер – UCU Гли - GGU CAC UCC GGC UCA GGA UCG GGG AGU AGC Способ кодирования - каждому белку соответствует своя аминокислота Свойства генетического кода: 1. Триплетен 2. Вырожден 3. Специфичен 4. Универсален 5. Колинеарен |
№ 4.9 В химиотерапии опухолей широко используется антибиотик дауномицин, который внедряется между основаниями ДНК, и аналог фолиевой кислоты – метотрексат. Активность каких процессов снижается при использовании этих препаратов? При ответе на этот вопрос: а) Укажите различие в механизме действия этих препаратов на синтез ДНК б) Напишите схемы реакций, скорость которых снижает метотрексат. а) Дауномицин – интеркалирует между парами оснований ДНК и нарушает репликацию и транскрипцию опухолевых клеток, нарушает биосинтез белка, клетка гибнет. Метотрексат – ингибирует дигидрофолатредуктазу, превращающую дигидрофолиевую кислоту, подавляет синтез ДНК. Наиболее чувствительны клетки опухолей, костного мозга эмбриона и слизистых оболочек полости рта, кишечника. б) 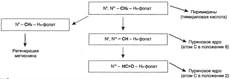 Эти одноуглеродные ферменты используются: 1. В регенерации незаменимой аминокислоты - Мет 2. В синтезе пуриновых оснований – А, Г 3. В синтезе пиримидиновой кислоты (пиримидинов) Эти одноуглеродные ферменты используются: 1. В регенерации незаменимой аминокислоты - Мет 2. В синтезе пуриновых оснований – А, Г 3. В синтезе пиримидиновой кислоты (пиримидинов) | № 4.10 Основные симптомы бактериальных заболеваний вызваны действием токсинов и белков, продуцируемых микроорганизмами. Так, дифтерийный токсин вызывает АДФ-рибозилирование фактора элонгации (EF2) в эукариотических клетках и нарушает синтез белка. На какой стадии роста полипептидной цепи участвует EF2? Для ответа на этот вопрос: а) Представьте схему событий на рибосоме и отметьте стадию, на которой произойдет остановка белкового синтеза б) Объясните, какова судьба клеток после воздействия токсина EF2 участвует на стадии элонгации. а) Инициация. 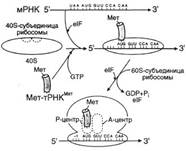 Элонгация. Элонгация. 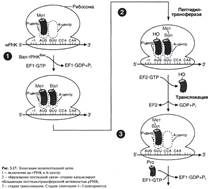 Терминация Терминация 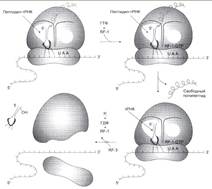 Остановится на стадии элонгации, так как дифтерийный токсин вызывает АДФ-рибозилирование фактора элонгации (EF2) Терминация – процесс, когда в A-центр попадает стоп-кодон UGA, UAG, UAA EF2 участвует на стадии транслокации. Остановка произойдёт на стадии транслокации. б) После воздействия токсина возможна остановка синтеза белка, гибель клетки и некроз ткани Остановится на стадии элонгации, так как дифтерийный токсин вызывает АДФ-рибозилирование фактора элонгации (EF2) Терминация – процесс, когда в A-центр попадает стоп-кодон UGA, UAG, UAA EF2 участвует на стадии транслокации. Остановка произойдёт на стадии транслокации. б) После воздействия токсина возможна остановка синтеза белка, гибель клетки и некроз ткани | № 4.11 При введении гормона альдостерона у животных наблюдается задержка Na+ из-за увеличения количества белков-переносчиков этих ионов. Объясните, как действует альдостерон на клетки мишени. Для этого: а) Назовите матричный процесс, который ускоряется первично при действии гормона б) Представьте схему процесса, активация которого вызывает увеличение количества белков-переносчиков Na+ в мембранах клеток. а) Альдостерон увеличивает скорость транскрипции Транскрипция. 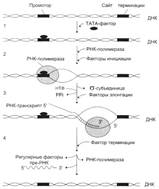 б) Механизм действия альдостерона б) Механизм действия альдостерона 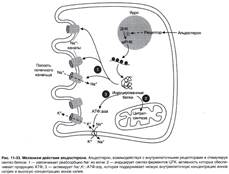 | |
№ 4.12 Действие стероидного гормона кортизола на печени приводит к увеличению количества ключевых ферментов, участвующих в синтезе глюкозы. Какой матричный процесс кортизола индуцирует первично? Отвечая на поставленный вопрос: а) Изобразите схему и напишите суммарное уравнение этого процесса б) Укажите, каким модификациям подвергается вновь синтезированная нуклеиновая кислота, чтобы служить матрицей для последующего синтеза белков. а) Транскрипция увеличивается при действии кортизола. 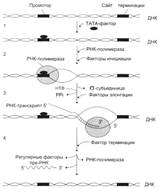 Суммарное уравнение: mАТФ + nУТФ + kЦТФ + l ГТФ → РНК + (m+n+k+l)H4P2O7 б) Посттранскрипционные модификации – сплайсинг. Суммарное уравнение: mАТФ + nУТФ + kЦТФ + l ГТФ → РНК + (m+n+k+l)H4P2O7 б) Посттранскрипционные модификации – сплайсинг. 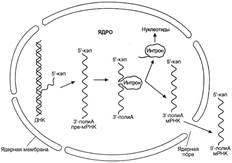 | |||
№ 4.13 Весь набор ферментов, участвующих в синтезе мочевины, присутствует только в клетках печени и его нет в клетках других органов. Как можно объяснить эти различия в белковом составе органов и тканей? При ответе на этот вопрос: а) Вспомните механизмы, с помощью которых формируются транскрипционно неактивные участки хроматина б) Объясните, когда в хроматине клеток возникают зоны стойкой репрессии и существует ли различная в них локализации в разных тканях а)Факторы, обеспечивающие формирование зон стойкой репрессии: 1. Фермент ДНК-метилаза (метилирование азотистых оснований). 2. Связывание с гистонами и образование нуклеосом 3. Негистоновые белки (+) Набор генов во всех клетках организма одинаков, а зоны стойкой репрессии затрагивают разные участки генома – в результате ткани по-разному дифференцированы. У эукариот регуляции транскрипции осуществляется с помощью энхансеров (белки-активаторы) и сайленсеров (белки-репрессоры). б)  Гетерохроматин находится в высококонденсированном состоянии. Гетерохроматин находится в высококонденсированном состоянии. | № 4.14 Фермент глюкозо-6-фосфатдегидрогеназа представлен в популяции людей множеством вариантов. Два из них различаются по одной аминокислоте: в 1-м варианте – Асп, во 2-ом варианте – Асн. Определите, являются ли описанные варианты фермента примером полиморфных белков. Для решения задачи: а) Используя таблицу генетического кода, укажите, какие изменения в кодоне гена этого фермента привели к появлению указанных вариантов б) Объясните, что такое полиморфизм белков и каковы причины его возникновения а) Асп Асн мРНК GAU GAC AAU AAC ДНК CTA CTG TTA TTG Мутация по типу замены нуклеотида б) Полиморфизм белков – это устойчивое существование в популяции нескольких вариантов одного и того же белка, которые возникли в результате мутаций и рекомбинаций в копиях одного и того же гена. | № 4.15 Результаты генетического обследования семьи (методом ПЦР), в которой являются носителями гена серповидно-клеточной анемии, представлены на рис. На основании полученных результатов объясните, кто из детей этой большой семьи здоров, болен, является носителем гена серповидно-клеточной анемии. Укажите, на чем основан принцип метода, каковы необходимые компоненты и условия проведения ПЦР. 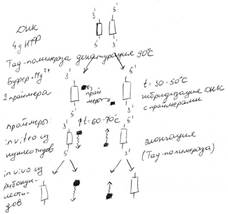 ПЦР – полимеразная цепная реакция Полученный материал подвергается фракциванию методом электрофорез в агазорном или полиакриламидном геле. В медицинской диагностике: 1. Идентифицировать вирусную и бактериальную ДНК в составе ДНК человека 2. Проводить пренатальную диагностику наследственных заболеваний 3. Выявить гетерозиготных носителей дефектных генов 4. Определить точную локализацию генов в ДНК человека 5. Идентифицировать дефектные гены, нарушающие регуляцию пролиферации клеток и вызывающие развитие опухолевых заболеваний 6. Проводить анализ препаратов, содержащих сильно деградированную ДНК ПЦР – полимеразная цепная реакция Полученный материал подвергается фракциванию методом электрофорез в агазорном или полиакриламидном геле. В медицинской диагностике: 1. Идентифицировать вирусную и бактериальную ДНК в составе ДНК человека 2. Проводить пренатальную диагностику наследственных заболеваний 3. Выявить гетерозиготных носителей дефектных генов 4. Определить точную локализацию генов в ДНК человека 5. Идентифицировать дефектные гены, нарушающие регуляцию пролиферации клеток и вызывающие развитие опухолевых заболеваний 6. Проводить анализ препаратов, содержащих сильно деградированную ДНК |
