Каталитическая. Многие белки являются ферментами
Регуляторная. Некоторые гормоны являются белками
Структурная. Во все структуры живой клетки входят белки.
Рецепторная. Белки являются обязательным компонентом рецепторов, способны узнавать другие молекулы.
Транпортная. Транспорт жиров, лекарственных веществ и д.р.
Опорная. Коллаген, белки костной ткани.
7.Энергетическая. Окисление 1 грамма белка сопровождается выделением 17 КДЖ энергии. В сутки 15% энергии образуется за счёт распада Б.
Сократительная. Актин, миозин мышц.
Генно-регуляторная (ГИСТОНЫ).
Иммунологическая. Антитела являются белками.
Гемостатическая. Фибриноген.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ. Свойства белков обусловлены их структурой.
ПЕРВИЧНАЯ СТРУКТУРА - последовательное соединение АК в ПОЛИПЕПТИДНОЙ цепи с помощью ПЕПТИДНЫХ связей.
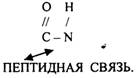
Свойства ПОЛИПЕПТИДНОЙ цепи зависят от составляющих её АК.
Порядок АК в цепи устанавливается с помощью СЕКВЕНИРОВАНИЯ - процедура выявления последовательности АК. Впервые было проведено в 1958 г. Ф. СЕНДЖЕРОМ на инсулине.
ВТОРИЧНАЯ СТРУКТУРА - способ укладки в пространстве ПОЛИПЕПТИДНОЙ цепи. Образуется за счет водородных связей между 1 и 4 АК.
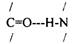
Выделяют 3 вида вторичной структуры:
Альфа спираль ( Л.ПОЛЛИНГ) - виток составляет от 3 до 6 АК. Терминатором спирали является АК-ПРОЛИН.
Бетта складчатый слой.
Петли ПОЛИПЕПТИДНОЙ цепи (соединительные петли).
ТРЕТИЧНАЯ СТРУКТУРА - укладка вторичной структуры более компактно, в виде ГЛОБУЛЫ или ФИБРИЛЛЫ. Осуществляется за счёт водородных, ионных, ДИСУЛЬФИДНЫХ и гидрофобных связей.
Домены - это фрагменты ПОЛИПЕПТИДНОЙ цепи, сходные по свойствам с самостоятельными глобулярными белками. Домен автономен. Домены возникают в результате слияния нескольких генов отдельных белков.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА - объединение нескольких доменов. П. Гемоглобин-4 СУБЪЕДИНИЦЫ.
ЛЕКЦИЯ № 2.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. КЛАССИФИКАЦИЯ БЕЛКОВ.
Физико-химические свойства белков. Их использование для разделения белков.
Принципы классификации белков.
Характеристика простых белков.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики.
Молекулярная масса: инсулин (5700)
МИОГЛОБИН (17000)
ПЕПСИН (35000)
ГЕМОГЛОБИН (65000).
Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ, т.е. при ускорении 100000-500000 дальтон. На основании этого определяют коэффициент седиментации, который обозначают S ( в честь СВЕДБЕРГА). Он предложил за единицу коэффициента седиментации величину 10-13 степени. S большинства белков колеблется в пределах 1-2 СВЕДБЕРГОВ. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса.
Способность белков связываться с ЛИГАНДАМИ,
Белки способны связываться с определенными веществами. Белки специфично узнают свои ЛИГАНДЫ, что обусловлено комплиментарным строением определённого участка белка и ЛИГАНДЫ.
Fe2+ O2. ИЗБИРАТЕЛЬНОСТЬ обеспечивается белковой частью гемоглобина. Центр связывания ЛИГАНДА называется активным центром. Это свойство лежит в основе др. метод разделения белков - АФФИНАЯ ХРОМОТОГРАФИЯ (разделение по сродству).
Электрохимические свойства белков.
А. АМФОТЕРНОСТЬ.
