Методы и концепции познания в химии
Химические знания до определенного времени накапливались эмпирически, пока не назрела необходимость в их классификации и систематизации, т.е. в теоретическом обобщении. Основоположником системного освоения химических знаний явился Д.И. Менделеев. Попытки объединения элементов в группы предпринимались и ранее, однако не были найдены определяющие причины изменений свойств химических веществ.
Д.И. Менделеев исходил из принципа, что любое точное знание представляет систему. Такой подход позволил ему в 1869 г. открыть периодический закон и разработать Периодическую систему химических элементов. В его системе основной характеристикой элементов являются их атомные веса. Периодический закон Д.И. Менделеева сформулирован в следующем виде: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов»1.
Это обобщение давало новые представления об элементах, но в силу того, что еще не было известно строение атома, физический смысл его был не вполне доступен пониманию. В современном представлении этот периодический закон формулируется следующим образом: «Строение и свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атомов и
1 Кузьменко Н.Е., Еремин В.В. Указ. соч. С. 31.
определяются периодически повторяющимися однотипными электронными конфигурациями их атомов»1. В своей книге «Элементы», опубликованной в 1993 г., Дж. Эмсли определяет свойства элементов более, чем по 20 параметрам.
До системного подхода в химии Д.И. Менделеева учебники по химии были очень громоздкими и состояли из многих томов по несколько сот страниц. Учебник Д.И. Менделеева «Основы химии», выпущенный в 1868—1871 гг. и построенный на системных обобщениях, логично излагал в одной книге стройную систему знаний того времени.
Современная химическая наука опирается на ряд основных химических законов: закон сохранения массы (масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции); закон сохранения энергии (при любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы остается постоянной и возможны лишь переходы из одного вида энергии в другой); закон постоянства состава (любое химически индивидуальное соединение имеет один и тот же количественный состав независимо от способа его получения); закон кратных отношений (если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящихся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа); закон объемных отношений (при одинаковых условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие числа); закон Авогадро (в равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул) и другие законы2.
Современную картину химических знаний объясняют с позиций четырех концептуальных систем, которые схематично можно представить следующим образом3.
4. Эволюционная химия 3. Учение о химических процессах 2. Структурная химия 1. Учение о составе 1660-е гг. 1800-е гг. 1950-е гг. 1970-е гг. Наст, время
1 Глинка Н.Л. Общая химия. - М.: ИНТЕГРАЛ-ПРЕСС, 2002. - С. 79.
2 Там же. С. 19, 20.
3 Кузнецов В.И. и др. Указ соч. С. 177.
174
На рисунке показано последовательное появление новых концепций в химической науке, которые опирались на предыдущие достижения, сохраняя в себе все необходимое для дальнейшего развития.
О качественном росте знаний в химии при переходе от одной концептуальной системы к другой, более совершенной, и получении на их базе новых веществ можно судить на примере изготовления синтетического каучука.
Широкое развитие авто- и авиастроения потребовало производства каучука в гораздо больших масштабах, чем прежде. Назрела проблема получения искусственного каучука. В начале XX в. русский ученый С.В.. Лебедев получил каучук на основе дивинила. Однако этот процесс оказался дорогим и трудоемким. В 1928 г. С.В. Лебедев открыл продуктивный метод получения сырья для производства каучука из этилового спирта. Этим было положено начало промышленному синтезу каучука. Но и такое производство тоже оказалось чрезвычайно дорогостоящим. Исходное сырье дивинил синтезировали из этилового спирта, который получали из пищевых продуктов, содержащих крахмал и сахар, причем только третья часть спирта имела выход, остальное шло в отходы. Во всей цепи по производству каучука было занято значительное количество людей.
Новые возможности получения исходного сырья дивинила для производства каучука представились с выходом химических знаний на уровень учения о химических процессах. Дивинил стали получать из нефти, отпала необходимость в использовании пищевого сырья. Такое производство существует и сегодня.
Более обнадеживающие перспективы получения синтетического каучука представляются на новом — эволюционном уровне развития химии. Имеются сведения о пиролизе нефтяного сырья в условиях плазмы при температуре в 4—5 тыс. градусов, когда реакция проходит в течение тысячных долей секунды. В этих условиях производительность возрастает многократно по сравнению с существующим способом. Один человек, обслуживающий небольшой реактор-плазмотрон, может заменить целый завод.
Далее будут рассмотрены все четыре концептуальные системы.
Учение о составе вещества
На этом уровне решались вопросы определения химического элемента, химического соединения и получения новых материалов на базе более широкого использования химических элементов.
Первое научное определение химического элемента, когда еще не было открыто ни одного из них, сформулировал английский химик и физик Р. Бойль. Первым был открыт химический элемент фосфор в 1669 г., потом кобальт, никель и др. Открытие французским химиком А.Л. Лавуазье кислорода и установление его роли в образовании различных химических соединений позволило отказаться от прежних представлений об «огненной материи» (флогистоне). Лавуазье впервые систематизировал химические элементы на базе имевшихся в XVIII в. знаний. Эта систематизация оказалась ошибочной и в дальнейшем была усовершенствована Д.И. Мен-делеевым. Система Лавуазье определяла место элемента по атомной массе. В настоящее время место химического элемента определяют по заряду атомного ядра, который отражает индивидуальные свойства элемента. Например, элемент хлор имеет два изотопа (две разновидности), отличающиеся друг от друга по массе атома. Но оба они относятся к одному химическому элементу — хлору из-за одинакового заряда их ядер.
 |
В Периодической системе Д.И. Менделеева насчитывалось 62 элемента, в 1930-е гг. она заканчивалась ураном (Z = 92). В учебнике «Химия» выпуска 2002 г. автор Н.Л. Глинка дает на развороте «Периодическую систему элементов Д.И. Менделеева», содержащую 103 элемента. В 1999 г. в СМИ прошло сообщение, что путем физического синтеза атомных ядер открыт 114-й элемент.
Вопросы, связанные с химическими соединениями, длительное время не вызывали споров в среде химиков. Казалось очевидным, что именно относится к химическим соединениям, а что — к простым телам или смесям. Однако применение в последнее время физических методов исследования вещества позволило выявить физическую природу химизма, т.е. внутренние силы, которые объединяют атомы в молекулы, представляющие собой прочную квантово-механическую целостность. Такими силами оказались химические связи, проявляющие волновые свойства валентных электронов.
Электрон измеряется и как частица, и как волна, и как точечный заряд, а в силу движения на очень малых расстояниях он выглядит как электронное облако, располагающееся в поле действия атомного ядра. Химические связи представляют собой обменное взаимодействие электронов с соответствующими характеристиками.
В результате химических и физических открытий претерпело изменение классическое определение молекулы. Молекула понимается как наименьшая частица вещества, которая в состоянии определить его свойства и в то же время существовать самостоятельно. Представления о классе молекул расширились, в него включают ионные системы, атомные и металлические монокристаллы и полимеры, образующиеся на основе водородных связей и представляющие собой уже макромолекулы. Они обладают молекулярным строением, хотя и не находятся в строго постоянном составе.
С открытием физиками природы химизма как обменного взаимодействия электронов химики совершенно по-другому стали рассматривать химическое соединение. «Это качественно определенное вещество, состоящее из одного или нескольких химических элементов, атомы которых за счет обменного взаимодействия (химической связи) объединены в частицы — молекулы, комплексы, монокристаллы или иные агрегаты. Химическое соединение — понятие более широкое, чем "сложное вещество", которое должно состоять из двух и более разных химических элементов. Химическое соединение может состоять и из одного элемента. Это молекулы Н2, О2, графит, алмаз и другие кристаллы без посторонних включений в их решетку в идеальном случае»1.
Проблема производства новых материалов связана с включением в их состав новых химических элементов. Дело в том, что 98,7% массы слоя Земли, на котором осуществляет свою производственную деятельность человек, составляют восемь химических элементов: 47% — кислород, 27,5% — кремний, 8,8% — алюминий, 4,6% — железо, 3,6% — кальций, 2,6% — натрий, 2,5% — калий, 2,1 — магний. Однако эти химические элементы распределены на Земле неравномерно и также неравномерно используются. Более 95% изделий из металла в своей основе содержат железо. Такое потребление ведет к дефициту железа. Поэтому стоит задача использовать для человеческой деятельности и другие хими-
Кузнецов В.И. и др. Указ. соч. С. 192—193.
ческие элементы, способные заменить железо, в частности наиболее распространенный кремний. Силикаты, различные соединения кремния с кислородом и другими элементами составляют 97% массы земной коры. Исходя из этого, вполне естественно возникает проблема использования силикатов как основного вида сырья в возможно больших сферах человеческой деятельности — от строительства до машиностроения. Металлы и керамические изделия производятся почти в одинаковом количестве, но металлы в производстве обходятся значительно дороже.
На основе современных достижений химии появилась возможность замены металлов керамикой не только как более экономичным продуктом, но во многих случаях и как более подходящим конструкционным материалом по сравнению с металлом. Более низкая плотность керамики (40%) дает возможность снизить массу изготовляемых из нее предметов. Включение в производство керамики новых химических элементов: титана, бора, хрома, вольфрама и других позволяет получать материалы с заранее заданными специальными свойствами (огнеупорность, термостойкость, высокая твердость и т.п.).
В 60-е годы XX в. в нашей стране был получен сверхтвердый материал — гексанит-Р.Это одна из кристаллических разновидностей нитрида бора с температурой плавления 3200°С и твердостью почти как у алмаза. Данный материал к тому же обладает повышенной вязкостью, что не присуще керамике. Такая керамика получается прессованием порошков, что позволяет получать изделия необходимой формы и исключить их дальнейшую обработку. Кроме того, получена керамика, обладающая сверхпроводимостью, что открывает новые возможности в электронике.
Во второй половине XX в. стали использоваться все новые и новые химические элементы в синтезе элементоорганических соединений от алюминия до фтора. Часть таких соединений служит в качестве химических реагентов для лабораторных исследований, а другая — для синтеза новейших материалов.
6.4. Уровень структурной химии
Структурная химия представляет собой уровень развития химических знаний, на котором доминирует понятие «структура», т.е. структура молекулы, макромолекулы, монокристалла. «Структура —
это устойчивая упорядоченность качественно неизменной системы, каковой является молекула»1.
С возникновением структурной химии у химической науки появились неизвестные ранее возможности целенаправленного качественного влияния на преобразование вещества. Еще в 1857 г. немецкий химик Ф.А. Кекуле показал, что углерод четырехвалентен, и это дает возможность присоединить к нему до четырех элементов одновалентного водорода. Азот может присоединить до трех одновалентных элементов, кислород — до двух. Эта схема Кекуле натолкнула исследователей на понимание механизма получения новых химических соединений. А.М. Бутлеров заметил, что в таких соединениях большую роль играет энергия, с которой вещества связываются между собой. В настоящее время структура молекулы понимается как ее пространственная и энергетическая упорядоченность.
В 60—80-е годы XX в. было изучено такое явление, как органический синтез. Из каменноугольной смолы и аммиака были получены новые красители — фуксин, анилиновая соль, ализарин, а позднее — взрывчатые вещества и лекарственные препараты — аспирин и др. Структурная химия дала повод для оптимистических заявлений, что химики могут все.
Однако дальнейшее развитие химической науки и основанного на ее достижениях производства показали более точно возможности и пределы структурной химии. На ее уровне не представлялось возможным получение этилена, ацетилена, бензола и других углеводородов из парафиновых углеводородов. Многие реакции органического синтеза на основе структурной химии давали очень низкие выходы необходимого продукта и большие отходы в виде побочных продуктов. Вследствие этого их нельзя было использовать в промышленном масштабе.
Кроме того, для производства на основе органического синтеза использовалось дорогостоящее сельскохозяйственное сырье — зерно, жиры, молочные продукты. А сам технологический процесс был многоэтапным и трудноуправляемым.
В последнее время ученые открыли новую группу металлоор-ганических соединений с двойной структурой, из-за чего они получили название «сэндвичевых соединений». Это не что иное, как молекула, представляющая собой две пластины из соедине-
Кузнецов В.И. и др. Указ. соч. С. 203.
ний водорода и углерода, между которыми находится атом металла или атомы двух металлов. Пока данные соединения практического применения не нашли, но оказали влияние на пересмотр прежних взглядов на валентность и химические связи. Их рассматривают как доказательство наличия электронно-ядерного взаимодействия молекул.
Структурная химия неорганических соединений ищет пути получения кристаллов для производства высокопрочных материалов с заданными свойствами, обладающих термостойкостью, сопротивлением агрессивной среде и другими качествами, предъявляемыми сегодняшним уровнем развития науки и техники. Решение этих вопросов наталкивается на различные препятствия. Выращивание, например, некоторых кристаллов требует исключения условий гравитации, поэтому такие кристаллы выращивают в космосе, на орбитальных станциях.
6.5. Учение о химических процессах
Химические процессы представляют собой сложнейшее явление как в неживой, так и живой природе. Эти процессы изучают химия, физика и биология. Перед химической наукой стоит принципиальная задача — научиться управлять химическими процессами. Дело в том, что некоторые процессы не удается осуществить, хотя, в принципе, они осуществимы, другие трудно остановить — реакции горения, взрывы, а часть из них трудноуправляема, поскольку они самопроизвольно создают массу побочных продуктов. Для управления химическими процессами разработаны термодинамический и кинетический методы.
Все химические реакции имеют свойство обратимости, происходит перераспределение химических связей. Обратимость удерживает равновесие между прямой и обратной реакциями. В действительности равновесие зависит от условий прохождения процесса и чистоты реагентов. Смещение равновесия в ту или другую сторону требует специальных способов управления реакциями, например, реакция получения аммиака:
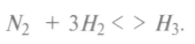
Эта реакция проста по составу элементов и своей структуре. Однако на протяжении целого столетия с 1813 по 1913 г. химики не
180
могли ее провести в законченном виде, так как не были известны средства управления ею. Она стала осуществимой только после открытия соответствующих законов нидерландским и французским физико-химиками Я.Х. Вант-Гофом и А.Л. Ле-Шателье. Было установлено, что «синтез аммиака происходит на поверхности твердого катализатора при сдвиге равновесия за счет высоких давлений»1.
Все проблемы, связанные с такими сложными процессами как, например, получение аммиака, решает химическая кинетика. Она устанавливает зависимость химических реакций от различных факторов — от строения и концентрации реагентов, наличия катализаторов, от материала и конструкции реакторов и т.д.
Эволюционная химия
Химики давно пытались понять, каким образом из неорганической безжизненной материи возникает органическая как основа жизни на Земле. Какая лаборатория лежит в основе этого процесса? Лаборатория, в которой без участия человека получаются новые химические соединения, более сложные, чем исходные вещества.
И.Я. Берцелиус первым установил, что основой живого является биокатализ, т.е. присутствие различных природных веществ в химической реакции, способных управлять ею, замедляя или ускоряя ее протекание. Эти катализаторы в живых системах определены самой природой, что и служит идеалом для многих химиков. Идеалом совершенства считали «живую лабораторию» немецкий ученый Ю. Либих, француз П.Э.М. Вертело и другие ученые.
Современные химики считают, что на основе изучения химии организмов можно разработать новое управление химическими процессами, а это позволит более экономично использовать имеющиеся в природе материалы и извлекать из них большую пользу. Для решения проблемы биокатализа и использования его результатов в промышленных масштабах химическая наука разработала ряд методов — изучение и использование приемов живой природы, применение отдельных ферментов для моделирования биокатализаторов, освоение механизмов живой природы, развитие исследований с целью применения принципов биокатализа в химических процессах и химической технологии.
Кузнецов В.И. и др. Указ. соч. С. 211.
В эволюционной химии существенное место отводится проблеме «самоорганизации» систем. Теория самоорганизации «отражает законы такого существования динамических систем, которое сопровождается их восхождением на все более высокие уровни сложности в системной упорядоченности, или материальной организации»1.
Для того чтобы начала действовать биологическая эволюция, природа на Земле создала необходимые химические элементы. Они возникают при очень высоких температурах при протекании ядерных реакций синтеза химических элементов. В начале образуются ядра протия (протоны), потом ядра гелия, бериллия, углерода, азота, кислорода и далее в определенной последовательности при соответствующих условиях другие элементы.
При температуре около 1010 степени по Кельвину возрастает и кинетическая энергия частиц звездной массы до такой степени, что силы гравитации не в состоянии удержать частицы вещества вместе и происходит взрыв звезды и ее последующее охлаждение. В этих условиях большая часть возникших элементов не может участвовать в ядерных реакциях и они остаются стабильными. При понижении температуры Земли ниже 5000 градусов по Кельвину вступает в силу химическая эволюция, которая дает различные химические соединения образовавшихся химических элементов.
В процессе самоорганизации предбиологических систем шел отбор необходимых элементов для появления жизни и ее функционирования. Из более 100 химических элементов, открытых к настоящему времени, многие принимают участие в жизнедеятельности живых организмов. Наука же считает, что только шесть элементов — углерод, водород, кислород, азот, фосфор и сера — составляют основу живых систем, из-за чего они и получили название органогенов.Весовая доля этих элементов в живом организме составляет 97,4%. Кроме того, в состав биологически важных компонентов живых систем входят еще 12 элементов: натрий, калий, кальций, магний, железо, цинк, кремний, алюминий, хлор, медь, кобальт, бор. Еще около 20 элементов участвуют в жизнедеятельности живых систем в зависимости от среды обитания и состава питания.
Не менее важно и то обстоятельство, что все элементы, участвующие в построении живых систем и их функционировании, распределены по всей поверхности Земли. Таким образом, жизнь
1 Кузнецов В.И. и др. Указ. соч. С. 240.
возникала в любом месте на Земле, где для этого создавались благоприятные условия. В космосе же преимущественно господствуют два элемента — водород и гелий, а остальные существуют в виде примесей и составляют ничтожно малую массу.
Особая роль отведена природой углероду. Этот элемент способен организовать связи с элементами, противостоящими друг другу, и удерживать их внутри себя. Атомы углерода образуют почти все типы химических связей. На основе шести органогенов и еще около 20 других элементов природа создала около 8 млн различных химических соединений, обнаруженных к настоящему времени; из них 96% приходится на органические соединения.
Из такого количества органических соединений в строительстве биомира задействованы природой всего несколько сотен. «Из 100 известных аминокислот в состав белков входит только 20; лишь по четыре нуклеотида ДНК и РНК лежат в основе всех сложных полимерных нуклеиновых кислот, ответственных за наследственность и регуляцию белкового синтеза в любых живых организмах»1.
Химики стремятся открыть секреты природы. Как она из такого ограниченного количества химических элементов и химических соединений образовала сложнейший высокоорганизованный комплекс — биосистему? Ответ на этот вопрос может дать возможность из имеющихся в избытке химических продуктов получать необходимые, дефицитные, например из загрязняющего атмосферу СО2 — сахар и т.д.
Поиски различного рода природных катализаторов позволяют химикам сделать ряд выводов (к этому различными путями пришли также геология, геохимия, космохимия, термодинамика, химическая кинетика):
1) на ранних стадиях химической эволюции мира катализ отсутствовал. Условия высоких температур — выше 5000 градусов по Кельвину, электрических разрядов и радиации препятствуют образованию конденсированного состояния;
2) первые проявления катализа начинаются при смягчении условий ниже 5000 градусов по Кельвину и образовании первичных тел;
3) роль катализатора возрастала по мере того, как физические условия (главным образом температура) приближались к земным.
Кузнецов В.И. и др. Указ. соч. С.243.
Но общее значение катализа (вплоть до образования более или менее сложных органических молекул) все еще не могло быть высоким;
4) появление таких даже относительно несложных систем, как СН3ОН; СН2 = СН2; НС = СН; Н2СО; НСООН; НС = N, а тем более оксикислот, аминокислот и первичных Сахаров, было своеобразной некаталитической подготовкой старта для большого катализа;
5) роль катализа в развитии химических систем после достижения стартового состояния, т.е. известного количественного минимума органических и неорганических соединений, начала возрастать с фантастической быстротой. Отбор активных соединений происходил в природе из тех продуктов, которые получались относительно большим числом химических путей и обладали широким каталитическим спектром1.
Функциональный подход к объяснению предбиологической эволюции сосредоточен на исследовании процессов самоорганизации материальных систем, выявлении законов, которым подчиняются такие процессы. Это в основном позиции физиков и математиков. Крайняя точка зрения здесь склоняется к тому, что живые системы могут быть смоделированы даже из металлических.
В 1969 г. появилась общая теория химической эволюции и биогенеза, выдвинутая ранее в самых общих положениях профессором Московского университета А.П. Руденко. Используя рациональность субстратного и функционального подходов, она отвечает на вопросы о «движущих силах и механизме эволюционного процесса, отборе элементов и структур и их причинной обусловленности, о высоте химической организации и иерархии химических систем как следствии эволюции»2.
Пока только эта теория в состоянии определить новую концептуальную систему, которая выходит за пределы учения о составе, структурной химии и учения о химических процессах. «Сущность этой теории состоит в том, что химическая эволюция представляет собой саморазвитие каталитических систем и, следовательно, эволюционирующим веществом являются катализаторы»3. В основе этой теории лежит утверждение о том, что процесс саморазвития химических катализаторов двигался в сторону
1 Кузнецов В.И. и др. Указ. соч. С. 245.
2 Там же. С. 246.
3 Там же. С. 246.
их совершенствования, шел постоянный отбор все новых катализаторов с большей реактивной активностью.
Открытый А.П. Руденко основной закон химической эволюции гласит, что эволюционные изменения катализатора происходят в том направлении, где проявляется его максимальная активность. Саморазвитие, самоорганизация и самоусложнение каталитических систем происходят за счет энергии базисной реакции. Поэтому эволюционируют каталитические системы с большей энергией. Такие системы разрушают химическое равновесие и в результате являются инструментом отбора наиболее устойчивых эволюционных изменений в катализаторе.
Теория развития каталитических систем открывает следующие возможности: вьывлять этапы химической эволюции и на этой основе классифицировать катализаторы по уровню их организации; использовать принципиально новый метод изучения катализа; дать конкретную характеристику пределов химической эволюции и перехода от химогенеза (химического становления) к биогенезу, связанного с преодолением второго кинетического предела саморазвития каталитических систем.
Набирает теоретический и практический потенциал новейшее направление, расширяющее представление об эволюции химических систем, — нестационарная кинетика.На ее основе разрабатывается теория управления нестационарными процессами. Уже наработанные в этой области эмпирические материалы приводят исследователей к выводу, что стационарность режима катализаторов является лишь частным случаем нестационарности. Появляются сведения о том, что нестационарные режимы создаются искусственно и способствуют интенсификации реакций в катализаторах.
Развитие химических знаний позволяет надеяться на разрешение многих проблем, которые встали перед человечеством в результате его наукоемкой и энергоемкой практической деятельности. Предполагается значительное ускорение химических превращений за счет освоения катализаторов будущего на принципиально новой основе, бережное и полное использование всех видов углеводородного сырья, а не только нефти, создание полностью безотходных производств.
Химическая наука уже имеет предпосылки для получения водорода из воды как самого высокоэффективного и экологически чистого топлива, для организации промышленного производства
по получению широкого спектра органических продуктов из углекислого газа, а также для промышленного производства различных материалов, где вместо углеводорода будут использоваться фторуглероды. Химическая наука ставит своей целью создание самых экономичных и экологически чистых производств и уже имеет для этого определенный потенциал.
На своем высшем эволюционном уровне химическая наука углубляет представления о мире. Концепции эволюционной химии, в том числе о химической эволюции на Земле, о самоорганизации и самосовершенствовании химических процессов, о переходе от химической эволюции к биогенезу, являются убедительным аргументом, подтверждающим научное понимание происхождения жизни во Вселенной.
Химическая эволюция на Земле создала все предпосылки для появления живого из неживой природы. А Земля оказалась в таких специфических условиях, что эти предпосылки смогли реализоваться. Жизнь во всем ее многообразии возникла на Земле самопроизвольно из неживой материи, она сохранилась и функционирует уже миллиарды лет. Жизнь полностью зависит от сохранения соответствующих условий ее функционирования, а это во многом зависит от самого человека. Видимо, одним из проявлений природы стало и появление человека как самосознающей себя материи. На определенном этапе он может оказывать ощутимое воздействие на среду собственного обитания, причем как позитивное, так и негативное. О генезисе жизни, ее структурных уровнях будет рассказано в следующей главе.
Вопросы для самоконтроля
1. От каких факторов зависят свойства веществ?
2. Объясните понятие «концептуальные системы химии».
3. Для чего химики изучают лабораторию «живой природы»?
4. Какими видятся конструкционные и строительные материалы будущего?
5. Кто является основоположником системного подхода в развитии химических знаний? Какую систему он построил?
6. Какие элементы называют органогенами и почему?
7. Каковы потенциальные возможности химии?
8. Что такое катализаторы?
9. Что подготовила химическая эволюция на Земле?
Библиографический список
1. Глинка Н.Л. Общая химия. - М.: ИНТЕГРАЛ-ПРЕСС, 2002.
2. Концепции современного естествознания. — М.: ЮНИТИ-ДАНА, 1999.
3. Кузнецов В.И., Идлис Г.М., Гутина В.Н. Естествознание. — М.: Агар, 1996.
4. Кузнецов В.И. Общая химия. Тенденции развития. — М.: Высшая школа, 1989.
5. Кузнецов В. И. Эволюция представлений об основных законах жизни. — М.: Наука, 1967.
6. Кузьменко Н.Е., Еремин В.В. Химия. Ответы на вопросы. — М.: I Федеративная книготорговая компания, 1997.
7. Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. — Минск.: Университетское, 1996.
8. Эмсли Дж. Элементы. — М.: Мир, 1993.
Глава 7
