Структура молекулы ДНК
Модуль III
Тема занятия №2: “Биологически важные аминокислоты. Белки. Нуклеиновые кислоты.”
Цель занятия: изучить строение и химические свойства биологически важных аминокислот, белков, нуклеиновых кислот и их роль в организме.
Студент должен знать:
- строение, прототропную таутомерию, классификацию α-аминокислот;
- строение, структуру и свойства пептидов;
- строение, свойства, структуру белков и их водных растворов;
- строение нуклеиновых кислот;
- лактим-лактамную и прототропную таутомерии азотистых оснований;
- структуру РНК и ДНК.
Студент должен уметь:
- классифицировать аминокислоты и нуклеиновые кислоты;
- объяснить амфотерность аминокислот, их химическое поведение;
- писать схемы образования мононуклеотидов.
Аминокислоты (АК) - это гетерофункциональные соединения, содержащие амино- и карбоксильную группы:
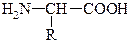
Номенклатура
Обычно АК имеют тривиальное название.
По рациональной номенклатуре их названия составляются путем прибавления к тривиальному названию приставки амино- и буквы греческого алфавита, указывающей положения – NH2 группы по отношению к – СООН.
МН в названии АК используется редко.
Изомерия
1. Изомерия цепи:
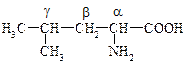 Лейцин, a-аминоизокапроновая к-та, a-амино-g-метилвалериановая к-та Лейцин, a-аминоизокапроновая к-та, a-амино-g-метилвалериановая к-та | 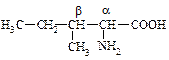 Изолейцин, a-амино-b-метил- валериановая к-та Изолейцин, a-амино-b-метил- валериановая к-та |
2. Изомерия положения гр. – NH2:
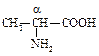 a-Аланин a-Аланин | 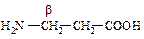 b-Аланин b-Аланин |
3. Оптическая изометрия (обладают все АК, кроме глицина). Отнесение к D- и L-ряду проводят по аналогии с глицериновым альдегидом по расположению Н и –NH2 гр.
Во всех случаях, когда a-АК содержит два и более асимметрических атомов углерода, конфигурацию ее определяют, исходя из a-углеродного атома.
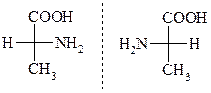 D- L- Аланин D- L- Аланин | 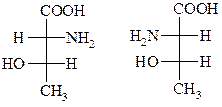 D-Треонин Алло-L-треонин D-Треонин Алло-L-треонин |
В организме обычно имеются L-, a- и алло-формы. В составе белков АК находятся только в L-форме. D-АК встречаются в антибиотиках (грамицидин).
Классификация
По числу –NH2, –COOH групп, а также в зависимости от R- АК подразделяют на: моноаминокарбоновые, моноаминодикарбоновые, диаминокарбоновые, ароматические и гетероциклические.
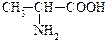 Аланин Аланин | 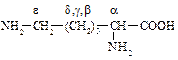 Лизин, a,e-диаминокапроновая к-та Лизин, a,e-диаминокапроновая к-та |
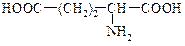 a-Аминоглутаровая к-та, Глутаминовая к-та a-Аминоглутаровая к-та, Глутаминовая к-та | 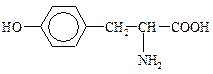 Тирозин, n-оксифенилаланин Тирозин, n-оксифенилаланин |
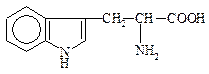
Триптофан,
b-индолилаланин,
3-индолил-2-аминопропановая к-та
Кроме вышесказанного выделяют также окси- и серусодержащие АК:
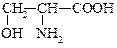 Серин a-амино-b-оксипропионовая к-та Серин a-амино-b-оксипропионовая к-та | 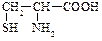 Цистеин, a-амино-b-тиопропионовая к-та Цистеин, a-амино-b-тиопропионовая к-та |
Живые организмы различаются по своей способности синтезировать АК. АК, не синтезируемые в организме, наз-ся незаменимыми. Это гетероциклические и разветвленные АК.
Химические свойства
I. Кислотно-оснóвные
АК за счет –I группы –NH2 являются более сильными к-тами, чем соответствующие им карбоновые к-ты и более слабыми основаниями, чем амины.
a-АК являются амфотерными соединениями, т.к. содержат в одной молекуле –NH2 гр., обусловливающую оснóвные св-ва и –СOOH – кислотные. Поэтому в зависимости от среды АК могут существовать в р-ре в виде катионов, анионов или диполярных ионов:

Значение рН р-ра, при котором АК имеет равное количество положительных и отрицательных зарядов, наз-ся изоэлектрической точкой (ИЭТ). Заряд белковой молекулы определяется суммой ионогенных групп –NH3+ и –COO–.
АК, как амфотерные соединения, образуют соли как с к-тами, так и с основаниями:
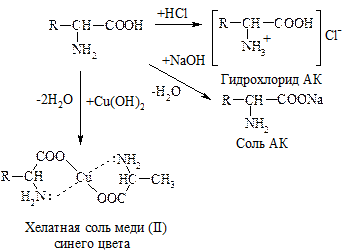
II. Р-ции по –СООН группе
АК могут диссоциировать, образовывать соли, сложные эфиры, ангидриды, амиды, хлорангидриды.
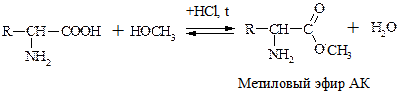
Эта р-ция используется как “защитная” в синтезе белков и пептидов.
III. Р-ции по –NH2 группе
а) Р-ция солеобразования (см.выше)
б) Р-ция с HNO2
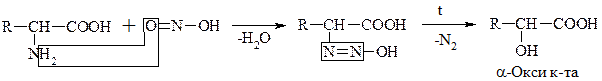
Эта р-ция дезаминирования in vitro. По количеству выделившегося азота определяют кол-во АК (метод Ван-Слайка).
в) Хлорангидриды и ангидриды к-т образуют с АК ацилпроизводные (подобно аминам и мочевине):
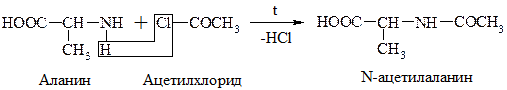
Эта р-ция используется для “защиты” –NH2 гр. в синтезе белков и пептидов.
г) Р-ция с формальдегидом
При взаимодействии с альдегидами a-АК, подобно первичным аминам, образуют основания Шиффа. Для аналитических целей применяется р-ция a-АК с формальдегидом, останавливающаяся на стадии N-гидроксиметильного производного АК (гидроксиметильной наз-ся гр. –СН2ОН):
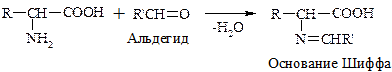
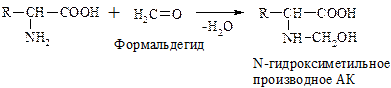
Последняя р-ция лежит в основе метода формольного титрования. Сами АК вследствие амфотерности не могут быть оттированы щелочью.
N-гидросиметильные производные АК содержат свободную –СООН гр. и могут быть определены количественно титрованием щелочью.
IV. Отношение АК к нагреванию
а) a-АК при нагревании могут отщеплять одну или две молекулы воды. При отщеплении одной молекулы воды образуются дипептиды:
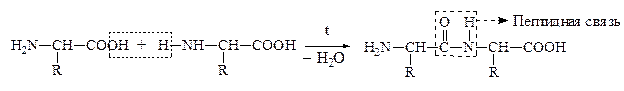
Дипептид обладает способностью взаимодействовать с новой молекулой АК с образованием трипептида, тетрапептида и полипептида. Последний является основой белковых молекул. Название ди– и полипептидов строится по названиям тех к-т, из которых они образуются. Поэтому АК, участвующая в образовании пептида имеет окончание –ИЛ, а концевая АК, сохранившая гр. –СООН – полное название:
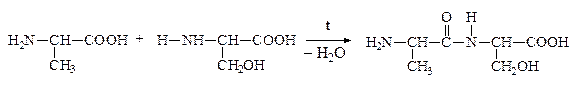
Аланин Серин АланИЛсерин
Используется сокращенная запись полипептида с указанием концевых групп и названий АК первыми тремя буквами русского или латинского алфавита:
Н2N – Ала – Тир – Гли – Глу – СООН
Аla Tyr Gly Glu
При отщеплении двух молекул воды от двух молекул АК образуется дикетопиперазин (циклический амид):
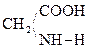 +
+ 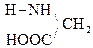
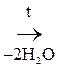
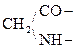
Глицин Дикетопиперазин
б) b-АК выделяют при нагревании NH3 и образуют непредельную к-ту, т.е. идет р-ция дезаминирования:
|
|
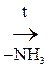
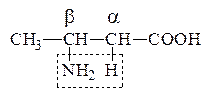
b-Аминомасляная к-та
в) g-АК образуют лактамы:
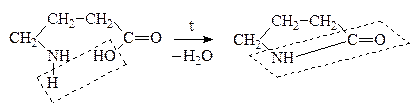
Лактамная
(пептидная) группа
|
g-Аминомасляная к-та
V. Р-ции дезаминирования:
В организме человека и животных под действием различных ферментов происходят процессы дезаминирования. Во всех случаях гр. -NH2 освобождается в виде NH3, а продуктами дезаминирования могут быть жирные к-ты, окси- и кеток-ты. При этом окислительное дезаминирование преобладает:
а) Окислительное дезаминирование
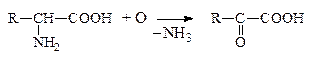
Оксок-та
б) Восстановительное
|
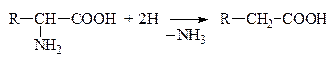
в) Гидролитическое
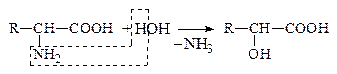
Оксик-та
г) Внутримолекулярное
|
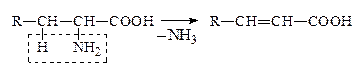
VI. Р-ции декарбоксилирования
Карбоновые к-ты in vitro декарбоксилируются в очень жестких условиях. Введение в a-положение ЭА групп -NH2, 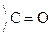 , –ОН способствует стабилизации карбоаниона и поэтому такие замещеные к-ты очень легко декарбоксилируются:
, –ОН способствует стабилизации карбоаниона и поэтому такие замещеные к-ты очень легко декарбоксилируются:
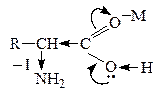
В лабораторных условиях АК легко декарбоксилируются в щелочной среде. В организме a-АК декарбоксилируются под действием фермента декарбоксилазы:
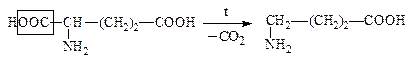
Глутаминовая к-та g-Аминомасляная к-та, ГАМК
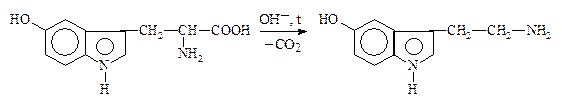
5-Окситриптофан 5-Окситриптамин,
серотонин
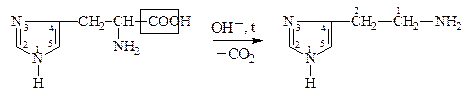
Гистидин, Гистамин,
a-амино-b-[4(5)-имидазолил]- 2-имидозолиламиноэтан,
пропионовая к-та 4(5)-аминоэтилимидазол
Образующиеся амины имеют большое физиологическое значение и наз-ся биогенными аминами. Они участвуют в ряде р-ций обмена нервной и сердечно-сосудистой систем.
К биогенным аминам, образующимся из тирозина в процессе обмена веществ, относится группа катехоламинов: адреналин, норадреналин и дофамин:
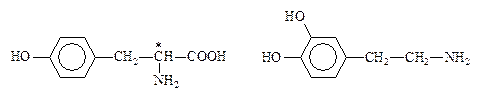
Тирозин Дофамин
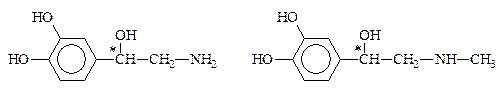
Норадреналин Адреналин
Дофамин, норадреналин и адреналин выполняют роль нейромедиаторов. Из тирозина синтезируются также пигменты кожи, глаз, волос.
Кроме р-ций декарбоксилирования в организме протекают под влиянием ферментов много строго специфических р-ций: переаминирования, трансаминирования и др.
VII. Р-ции по радикалу
Все циклические АК, содержищие бензольное кольцо – триптофан, тирозин, фенилаланин – легко вступают в р-ции замещения по бензольному кольцу с На12, НО–NO2, HO–SO3H.
Путем йодирования тирозина в организме образуется гормон щитовидной железы тироксин:
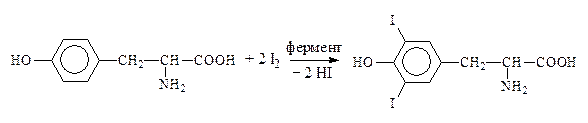
Тирозин Дийодтирозин
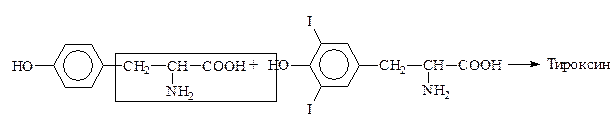
Качественная р-ция на ароматические АК – ксантопротеиновая – обусловлена нитрованием бензольного кольца с образованием нитросоединений желтого цвета. При добавлении к ним щелочи возникает оранжевое окрашивание:
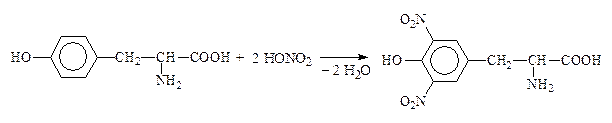
VIII. Качественная р-ция на a-АК
Это р-ция с нингидрином:
|
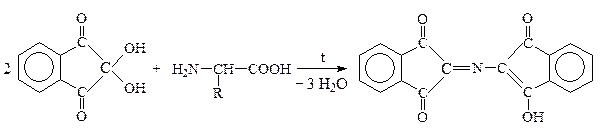 Нингидрин Продукт р-ции сине-фиолетового цвета
Нингидрин Продукт р-ции сине-фиолетового цвета + CO2 + R–CHO
Альдегид
IX. Р-ция на присутствие серусодержащих АК
|
|
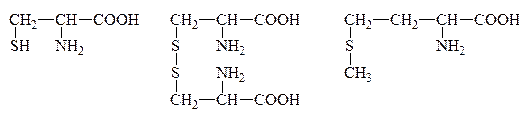
Цистин
Цистеин и цистин легко превращаются друг в друга за счет р-ции окисления-восстановления:
Цистеин 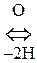 Цистин + Н2О
Цистин + Н2О
Обмен серы в организме идет, в основном, за счет цистина и цистеина. Они обусловливают структуру белка, реактивность многих ферментов и гормонов. Качественной р-цией на серусодержащие АК является р-ция Фоля:
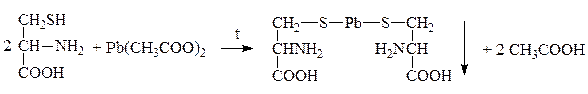
Коричневый
Белки
Это биополимеры, состоящие из ста и более АК остатков.
Классификация: простые белки (протеины), состоящие из a-АК, сложные белки (протеиды), состоящие из белковой и небелковой частей.
Аминокислотный состав определяет многие св-ва белков: заряд белковой молекулы, ИЭТ, способность к осаждению, структуру и биологическую активность.
В настоящее время синтезированы простейшие белки – инсулин, рибонуклеаза, окситацин и др.
Первичная структура
При всем многообразии пептидов и белков принцип построения их молекул одинаков – связь между a-АК осуществляется за счет –СООН гр. одной АК и –NH2 гр. другой АК, которая в свою очередь своей карбоксильной группой связывается с аминогруппой третьей АК и т.д. Связь между остатками АК, а именно между группой С=О одной к-ты и группой NH другой к-ты, является амидной связью. В химии пептидов и белков она наз-ся пептидной связью:
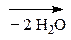
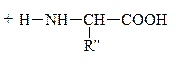

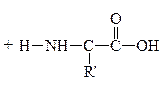

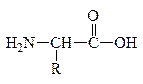


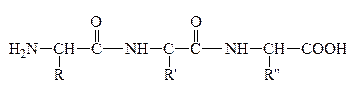
Пептидная связь
N-конец С-конец
Первичная структура пептидов и белков – это последовательность аминокислотных остатков в полипептидной цепи.
Вторичная структура
Цепи пептидов и белков принимают в пространстве определенную более или менее компактную форму. Уникальная особенность белковых молекул заключается в том, что они имеют, как правило, четкую пространственную структуру, или конформацию. Как только молекула окажется развернутой или уложенной иным способом в пространстве она почти всегда теряет свою биологическую функцию.
Л.Полинг, Р.Кори (1951) на основании расчетов предсказали наиболее выгодные способы укладки цепей в пространстве.
Пептидная цепь может укладываться в виде спирали (подобно винтовой лестницы). В одном витке спирали помещается около четырех АК остатков. Закрепление спирали обеспечивается водородными связями между группами С=О и NН, направленными вдоль оси спирали. Все боковые радикалы R АК находятся снаружи спирали. Такая конформация наз-ся a-спиралью. Другой вариант упорядоченной структуры полипептидной цепи – b-структура, или b-складчатый слой. В этом случае скелет находится в зигзагообразной конформации, и цепи располагаются параллельно друг другу, удерживаясь Н-связями.
Вторичная структура белка – это более высокий уровень структурной организации, в котором закрепление конформации происходит за счет Н-связей между пептидными группами.
Конформация белковой молекулы стабилизируется не только Н-связями, но и за счет некоторых ионных взаимодействий, а также за счет окисления SН-групп боковых радикалов R возникает ковалентная дисульфидная связь.
Третичная структура
Это укладка полипептидной цепи, включающей элементы той или иной вторичной структуры в пространстве, т.е. образование трехмерной конфигурации белка.
Чаще всего это – клубок. Стабилизируют третичную структуру Н-связи, электростатическое взаимодействие заряженных групп, межмолекулярные силы Ван дер Ваальса, гидрофобные взаимодействия.
Четвертичная структура
Несколько отдельных полипептидных цепей способны укладываться в более сложные образования, называемые также комплексами или агрегатами. При этом каждая цепь, сохраняя характерную для нее первичную, вторичную и третичную структуры, выступает в роли субъединицы комплекса с более высоким уровнем пространственной организацией – четвертичной структурой. Такой комплекс представляет собой единое целое и выполняет биологическую функцию, не свойственную отдельно взятым субъединицам. Четвертичная структура закрепляется за счет Н-связей и гидрофобных взаимодействий между субъединичными полипептидными цепями.
Определение четвертичной структуры белковых агрегатов возможно только с помощью высокоразрешающих физикохимических методов (рентгенография, электронная микроскопия) . Четвертичная структура характерна лишь для некоторых белков, например, гемоглобина. Главная функция гемоглобина (основного компонента эритроцитов) состоит в переносе кислорода из легких к тканям организма. Его четвертичная структура – образование из четырех полипептидных цепей (субъединиц), каждая из которых содержит гем.
Физико-химичекие св-ва
Для белков характерны высокая вязкость р-ров, низкая диффузия, способность к набуханию, подвижность в электрическом поле, низкое осмотическое давление.
Белки, как и АК, амфотерны за счет свободных групп –NН2 и –СООН.
В зависимости от рН среды, соотношения кислых и оснóвных АК остатков белки несут положительный или отрицательный заряды, что и используется при электрофорезе.
Подобно биурету полипептиды и белки дают качественную р-цию с Сu(ОН)2 – красно-фиолетовое окрашивание и она наз-ся биуретовой р-цией.
Белки отличаются друг от друга по составу, форме, растворимости, биологической активности, молярной массе. Часть из них синтезируется в организме, другие должны поступать извне. Они состоят в основном из 20 АК остатков.
Строение белков было установлено на основе р-ций гидролиза. По продуктам гидролиза все белки делят на две группы:
Простые Сложные
(протеины) (протеиды)
Это белки крови: альбумин, Гемоглобин (НЬ), цитохромы,
глобулин, фибриноген и др. флавопротеиды и др.
При гидролизе простых белков При гидролизе сложных белков
образуется только АК образуются АК+др. соединения
(Ме, липиды, углеводы,
комплексные соединения и пр.)
Фибриллярные белки– это белки, молекулы которых состоят из параллельных, сравнительно вытянутых пептидных цепей, образуют палочковидные структуры. Они не растворимы и выполняют структурную и защитную функции в организме. Например, коллаген при нагревании превращается в беспорядочные клубки, получившие название желатины (в ней много глицина, гидроксипролина, гидроксилизина).
Глобулярные белки – это белки молекулы которых состоят из плотно свернутых полипептидных цепей и имеют форму, близкую к сферической. К ним относятся ферменты, антитела, гормоны, альбумин, гемоглобулин и др. Они растворимы в водно-солевых р-рах.
Некоторые белки, например, миозин и фибриноген имеют палочковидную структуру, однако хорошо растворимы в воде.
Денатурация белков
Под влиянием многих факторов пространственная структура способна разрушаться, что приводит к потере биологической активности белков. К таким факторам относятся повышенная температура, изменение рН среды, УФ – и рентгеновское излучения, механическое воздействие (встряхивание), соли тяжелых Ме, алкалоиды и др.
Денатурация белков – это разрушение их природной (нативной) пространственной структуры с сохранением первичной структуры. Денатурация редко бывает обратимой. В этих немногих случаях важно то, что беспорядочно скрученная молекула денатурированного белка самопроизвольно принимает нативную пространственную структуру с полным сохранением биологической функции.
В случаях отравления солями тяжелых Ме (ртути, свинца, серебра и др.) в качестве противоядия используют белки с повышенным содержанием кислотных групп, например яичный альбумин. Он действует как конкурент белков организма и сам связывает токсичный агент, образуя с ним нерастворимую соль, которая затем выводится из организма.
В организме содержится более 50.000 различных белков. Кожа содержит 63% от массы сухой ткани, кости – 20%, зубы – 18%.
Функции белков:
1. Питательная (энергетическая – 20-25% – на белки), 17,6 кДж/г.
2. Транспортная (переносчики различных веществ) – гемоглобин, миоглобин и др.
3. Сократительная (белки мышечных тканей) – миозин и др.
4. Структурная (пластическая) – коллаген, фиброин, мембранные белки.
5. Каталитическая (белки-ферменты) – пепсин, каталаза, уреаза и др.
6. Регуляторная (белки-гормоны) – инсулин, вазопрессин и др.
7. Защитная (белки-антитела) – g-глобулины сыворотки крови.
8. Осмотическая, буферная, водно-солевая.
Нуклеиновые к-ты (НК)
НК являются природными высокомолекулярными соединениями. Молекулярная масса НК колеблется от 200 тысяч до 20 миллионов. Они играют важную роль в передаче наследственных признаков и осуществляют контроль за синтезом специфических белков в организме.
Химический состав НК
В молекулах НК содержатся фосфорная к-та, пентозы и азотистые основания.
Пентозы в НК представлены рибозой и 2-дезоксирибозой в b-фуранозной форме:
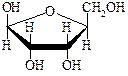 b- Рибоза b- Рибоза | 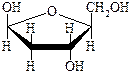 2-b -Дезоксирибоза 2-b -Дезоксирибоза |
Именно по характеру углеводного компонента–пентозы – все НК делятся на две большие группы:
1) рибонуклеиновые к-ты (РНК), содержащие рибозу,
2) дезоксирибонуклеиновые к-ты (ДНК), содержащие дезоксирибозу.
Азотистыми основаниями в НК являются производственные пурина и пиримидина.Из пуриновых оснований наиболее часто встречаются в составе НК аденин и гуанин:
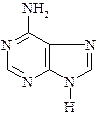 Аденин, 6-аминопурин Аденин, 6-аминопурин | 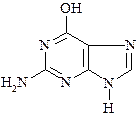 Гуанин, 2-амино-6-гидроксипурин Гуанин, 2-амино-6-гидроксипурин |
Из производных пиримидина чаще всего обнаруживаются цитозин, урацил, тимин, которые входят в состав НК в лактамной форме:
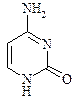 Цитозин, 2- гидроксо-4-амино- пиримидин Цитозин, 2- гидроксо-4-амино- пиримидин | 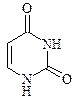 Урацил, 2,4- дигидроксо- пиримидин Урацил, 2,4- дигидроксо- пиримидин | 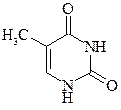 Тимин, 5- метилурацил, 2,4- дигидроксо- 5- метилпиримидин Тимин, 5- метилурацил, 2,4- дигидроксо- 5- метилпиримидин |
НК отличаются по составу азотистых оснований. Аденин, гуанин и цитозин входят в состав РНК и ДНК. Урацил содержится только в РНК, а тимин – в ДНК. При написании названия азотистых оснований их часто обозначают первыми заглавными буквами: А- аденин, Ц- цитозин и т.д.
Нуклеозиды
Пентозы, соединяясь с азотистыми основаниями, образуют нуклеозиды. Пуриновые основания присоединяются по 9, а пиримидиновые по 1 атому азота b-N- гликозидной связью. Схема образования пуринового нуклеозида:
| |
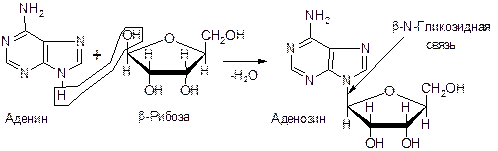
Схема образования пиримидинового нуклеозида:
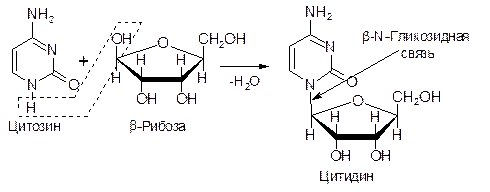
При названии пуриновых нуклеозидов окончание- ИН меняется на-ОЗИН: аденозин, гуанозин. Если в состав нуклеозида входит 2-дезоксирибоза, – перед названием нуклеозида ставится приставка ДЕЗОКСИ:
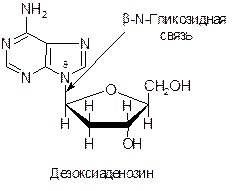
Пиримидиновые нуклеозиды получают окончание- ИДИН: цитидин, тимидин, уридин. Приставка дезокси- ставится только перед нуклеозидом, содержащим цитозин, т.к. тимин может соединяться только с 2- дезоксирибозой, а урацил только с рибозой.
Мононуклеотиды
Это продукты взаимодействия нуклеозидов с фосфорной к-той. H3PO4 присоединяется по 5-ому или 3-ему атому углерода пентозы сложноэфирной связью.
При названии мононуклеотидов к названию нуклеозида приписывается цифра 5¢ и слово "фосфат", обозначающее остаток фосфарной к-ты – PO3H2: цитидин – 5¢-фосфат, уридин -5¢-фосфат, аденозин -5¢-фосфат, дезоксигуанозин -5¢-фосфат, дезоксицитидин-5¢-фосфат. Мононуклеотиды являются структурными фрагментами НК, ферментов, витаминов (В2, НАД+).
Схема образования мононуклеотида:
|
|
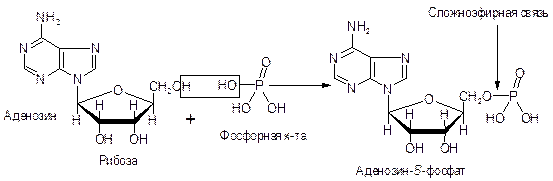
Нуклеозид может присоединять два и три остатка фосфорной к-ты, образуя ди- и трифосфаты. При этом ангидридная связь между остатками фосфорной к-ты может быть макроэргической, т.е. содержать большой запас энергии. Это наблюдается в аденозинтрифосфате (АТФ). Одна такая связь при расщеплении выделяет » 32 кДж/моль.
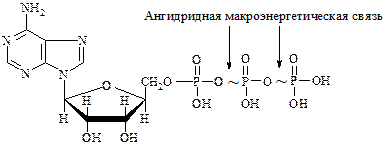
Аденозинтрифосфат, аденозинтрифосфорная к-та, АТФ.
АТФ является аккумулятором энергии в организме, универсальным первоисточником фосфорной к-ты при различных жизненных процессах.
Строение НК
Первичная структура НК представляет собой длинную цепь мононуклеотидов. Мононуклеотиды связаны, между собой за счет остатков фосфорной к-ты 3¢, 5¢- сложноэфирной связью:

|
Структура молекулы ДНК
Английские ученые Дж. Уотсон и Ф. Крик (1953) предложили пространственную модель молекулы ДНК. Согласно этой модели, макромолекула представляет собой спираль, состоящую из двух полинуклеотидных цепей, закрученных вокруг общей оси. Пуриновые и пиримидиновые основания направлены, внутрь спирали. Между пуриновым основанием одной цепи и пиримидиновым основанием другой возникают водородные связи. Эти основания составляют комплементарные пары:
А=Т (соединены двумя Н- связями), ГºЦ (три Н-связи).
Т.о., вторичная структура ДНК- это двойная спираль, образующаяся за счет Н- связей между комплементарными парами гетероциклических оснований и сил Ван дер Ваальса между азотистыми основаниями.
Водородные связи образуются между – NH группой одного основания и

|
|
|

|


 , а также между амидными и имидными атомами азота
, а также между амидными и имидными атомами азота Н-связи стабилизируют двойную спираль.
Комплементарность цепей – химическая основа важнейших функций ДНК– хранения и передачи наследственных признаков. В ДНК содержатся всего четыре основания (А, Г, Ц, Т). Кодирующей единицей для каждой АК белка является триплет (код из трех оснований). Участок молекулы ДНК, содержащий в последовательности своих нуклеотидов информацию о последовательности аминокислотных звеньев в синтезируемом белке, называют геном. В макромолекуле ДНК содержится много генов.
Однако нуклеотидная последовательность ДНК под действием различных факторов может подвергаться изменениям, которые называют мутациями. Наиболее распространенный вид мутации – замена какой-либо пары оснований на другую. Причина – сдвиг таутомерного равновесия. Например, замена обычной пары Т-А на пару Т-Г. При накоплении мутаций возрастает число ошибок в биосинтезе белка. Вторая причина возникновения мутации – химические факторы, а также различные виды излучений. Мутации под действием химических соединений имеют большое значение для управления наследственностью с целью ее улучшения – селекция сельскохозяйственных культур, создание штаммов микроорганизмов, производящих антибиотики, витамины, кормовые дрожжи.
Макромолекула РНК, как правило, представляет собой одну полипептидную цепь, принимающую различные пространственные формы, в том числе и спиралеобразные.
Молекулы ДНК находятся в ядрах клеток, а синтез белка осуществляется в цитоплазме на рибосомах при участии РНК, которые копируют генетическую информацию, переносят ее к месту синтеза белка, участвуют в процессе синтеза белка.
Нуклеотиды имеют большое значение не только как строительный материал для НК. Они участвуют в биохимических процессах, например в энергетическом обмене клетки (АТФ), переносе фосфатных групп, в окислительно-восстановительных р-циях и др.
Успехи в изучении строения НК и их функции привели к развитию новой ветви биологический науки – генной инженерии, позволяющей управлять внутриклеточными процессами. Отсюда исключительные перспективы в решении проблем медицины (предупреждение и лечение болезней), промышленности (например, биотехнологии на основе использования новых микроорганизмов, которые, благодаря наличию новых генов, синтезируют новые соединения) и т.д. Эти научные достижения показывают, что в основе процессов жизнедеятельности организмов лежат реальные химические процессы, протекающие в клетках на молекулярном уровне.
Вопросы для самоконтроля:
1. Что такое аминокислоты?
2. Как классифицируются аминокислоты?
3. Какие виды номенклатуры используются для аминокислот?
4. Какие аминокислоты входят в состав белков организма?
5. Что представляет собой аминокислота в кислой, основной и нейтральной средах? Напишите эти структуры для фенилаланина.
6. Напишите уравнения реакций серина (2-амино-3-гидроксипропановой кислоты) с:
а) аммиаком; б) гидроксидом натрия; в) азотистой кислотой;
г) ангидридом уксусной кислоты; д) азотной кислотой.
7. Какие продукты получаются при нагревании α - , β - , γ – амнокилот? Чем это можно объяснить?
8. Напишите реакцию декарбоксилирования гистидина.
9. Опишите качественные реакции на аминокислоты и белки.
10. Что такое белки? Как они классифицируются?
11. Опишите структуру белка.
12. Какие функции белков в организме?
13. Что такое нуклеиновые кислоты? Каков их химический состав?
14. Напишите схему образования двух нуклеозидов: а) из β –D – рибофуранозы и гуанина; б) из β –D – дезоксирибофуранозы и Тимина.
15. Напишите строение участка РНК с последовательностью оснований аденинурацил.
16. Какова биологическая роль нуклеиновых кислот?
Лабораторная работа
“Свойства аминокислот”
Опыт 1 Реакция глицина с нингидрином
В пробирку поместите 4 капли 1%-го р-ра глицина и 2 капли 0,1%-го р-ра нингидрина. Содержимое пробирки осторожно нагрейте. Что наблюдаете?
Напишите реакцию.
Опыт 2 Реакция глицина с азотистой кислотой
В пробирку поместите 5 капель 1%-го р-ра глицина и равный объем каплю 5%-го р-ра нитрита натрия. Добавьте 2 капли концентрированной уксусной кислоты и осторожно взболтайте смесь. Наблюдайте выделения газа.
Эта реакция используется для количественного определения аминогрупп в аминокислотах.
Напишите схему взаимодействия глицина с азотистой кислотой. Назовите образовавшиеся соединения.
Опыт 3 Образование комплексной соли меди глицина
В пробирку поместите 1 мл 1%-го р-ра глицина. Добавьте на кончике лопаточки кристаллический карбонат меди (II) и смесь нагрейте. Что наблюдаете?
Напишите схему взаимодействия глицина с карбонатом меди (II).
Опыт 4 Биуретовая реакция на пептидную связь
В пробирку поместите 5 капель р-ра яичного белка, добавьте равный объем 10%-го р-ра гидроксида натрия и по стенке добавьте 2 капли р-ра сульфата меди (II). Что наблюдаете?
Напишите схему образования биурета. Все ли белки дают биуретовую реакцию?
Опыт 4 Ксантопротеиновая реакция белков
В пробирку поместите 10 капель р-ра яичного белка и 2 капли концентрированной азотной кислоты. Содержимое пробирки осторожно нагрейте, постоянно встряхивая. Что наблюдаете? Охладив пробирку, осторожно добавьте 3 капли 10%-го р-ра гидроксида натрия до появления ярко – оранжевой окраски.
Какие α – аминокислоты в составе белка можно открыть с помощью касантопротеиновой реакции.
Опыт 5 Реакция на присутствие серусодержащих α – аминокислоты (реакция Фола)
В пробирку поместите 10 капель р-ра яичного белка и 20 капель 10%-го р-ра гидроксида натрия. Содержимое пробирки перемешайте и нагрейте до кипения. К полученному щелочному р-ру добавьте 5 капель 10%-го р-ра ацетата свинца (CH3COO)2Pb и вновь прокипятите. Что наблюдаете?
Напишите в общем виде схему реакции белка с ацетатом свинца (II). Какие α – аминокислоты в составе белка можно открыть с помощью реакции Фола.
Тесты “Аминокислоты” для самостоятельной работы студентов
