Изоэлектрическое состояние
ВМС могут быть неэлектролитами и электролитами, если полимер содержит ионогенные группы. Поскольку групп таких много, то это полиэлектролиты (поликислоты, полиоснования) или полиамфолиты, если содержат и кислотные, и основные группы (белки). По соотношению – СООН и NH2 групп белки делятся на:
нейтральные кислые основные
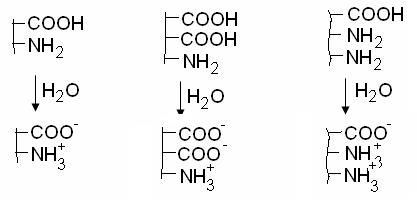
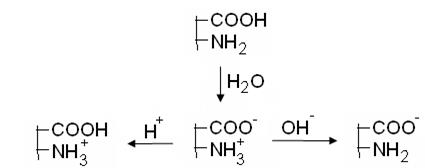
В водном растворе происходит диссоциация ионогенных групп. Макромолекула приобретает заряд. Этот заряд зависит, во-первых, от характера белка (нейтральный, кислый, основной). Так, при одном и том же значении рН, например при рН=7 в воде, все три белка имеют разные заряды. Во-вторых, заряд макромолекулы зависит от рН среды, как это видно на схеме для нейтрального белка.
 |
кислая среда рJ=7 щелочная среда рН
 Диссоциация влияет на конформацию макромолекул. У заряженных макромолекул происходит отталкивание одноименно заряженных групп, поэтому цепи, свернутые в клубок, раскручиваются, увеличивается размер, изменяются их свойства.
Диссоциация влияет на конформацию макромолекул. У заряженных макромолекул происходит отталкивание одноименно заряженных групп, поэтому цепи, свернутые в клубок, раскручиваются, увеличивается размер, изменяются их свойства.
При некоторых значениях рН может реализоваться изоэлектрическое состояние макромолекул, при котором число ионизированных кислотных и основных групп одинаково, а суммарный заряд равен нулю.
 Значение рН, при котором достигается изоэлектрическое состояние, когда суммарный заряд макрмолекулы равен нулю, называется изоэлектрической точкой, рJ.
Значение рН, при котором достигается изоэлектрическое состояние, когда суммарный заряд макрмолекулы равен нулю, называется изоэлектрической точкой, рJ.
В кислой среде при рН < рJ белки заряжены положительно, являются катионами. В щелочной среде при рН > рJ белки заряжены отрицательно, т.е. являются анионами.
Поскольку в изоэлектрическом состоянии макромолекула максимально плотно упакована в клубок из-за электростатического притяжения противоположно заряженных ионогенных групп, поэтому в изоэлектрической точке проявляются минимальные значения свойств растворов:
степень набухания
светорассеяние
осмотическое давление
вязкость
электроподвижность
устойчивость.
Изоэлектрическую точку можно определить разными способами: с помощью электрофореза, по скорости желатинирования, по степени набухания. По величене рJ можно определить характер белка: нейтральные белки имеют рJ ≈7, у кислых белков рJ лежит в кислой среде, у основных – в щелочной.
 5.3. Набухание и растворение ВМС.
5.3. Набухание и растворение ВМС.
В отличие от растворения низкомолекулярных веществ, растворение полимеров всегда начинается со стадии набухания.
Набухание – это самопроизвольный процесс проникновения растворителя между макромолекулами полимера, т.е. его односторонняя диффузия, сопровождающаяся увеличением объема и массы полимера.
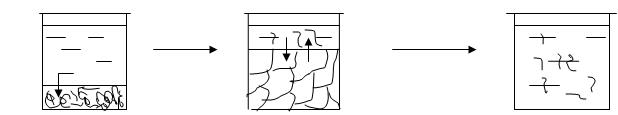
а) диффузия б) набухание в) растворение
растворителя
Рис.5.1 Стадии набухания
Набухание протекает в несколько стадий. При контакте полимера с растворителем начинается односторонняя диффузия мелких молекул растворителя в полимер, а крупные макромолекулы практически не диффундируют. Молекулы растворителя проникают между цепями полимера, раздвигают их, ослабляя связи между макромолекулами. Увеличивается масса и объем полимера. Количественной мерой набухания является степень набухания, выраженная через изменение массы или через изменение объема ВМС.
α = 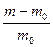 или α =
или α = 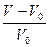 (5.1)
(5.1)
Набухание может на этом закончиться (ограниченное набухание). Максимально набухший полимер называют гелем или студнем.Если макромолекулы начинают диффундировать в растворитель, происходит неограниченное набухание или растворение полимера. Образуется однофазная гомогенная система.
Роль набухания в природе велика, например, любое зерно, прежде чем дать росток, должно набухнуть. Поэтому важно знать, какие факторы влияют на процесс набухания. Степень набухания (α) зависит от следующих условий:
|
1.В соответствии с правилом «подобные с подобным» полярные полимеры лучше набухают в воде, а неполярные - в бензоле.
2. Повышение температуры, как правило, способствует набуханию, т.к. при этом усиливается движение частиц и это способствует разрыхлению структур. Например, желатин или крахмал в теплой воде лишь набухают, а в горячей воде полностью растворяются.
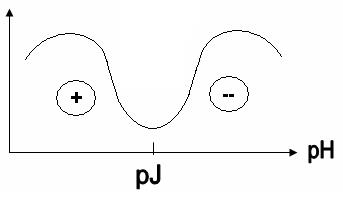
3.Влияние рН на набухание больше всего проявляется в растворах белков и полимеров с ионогенными группировками, т.к. их молекулы являются полиамфолитами. В изоэлектрической точке, когда суммарный заряд макромолекулы равен нулю, макромолекулы не отталкиваются, набухание минимально (рис.5.2). Изменение рН в более кислую или щелочную область от ИЭТ увеличивает степень набухания по двум причинам:
а) одноименно заряженные макромолекулы отталкиваются, и в пространство между ними начинает проникать вода.
б) появление заряда у макромолекул способствует их гидратации и разрыхлению структуры.
 степень набухания
степень набухания
 | |
 |
|
Например, при уксусе муравья или ожоге крапивой, когда в кожу попадает кислота, появляется опухоль – чрезмерно набухший участок кожной ткани. В сильно кислой или сильно щелочной среде макромолекула опять скручивается из-за подавления диссоциации солевых групп белка одноименными катионами или анионами:
Pt – COONa  Pt – COO– + Na+
Pt – COO– + Na+
4. Добавление солей, как правило, уменьшает набухание. При этом большее влияние оказывают анионы. По влиянию на набухание анионы располагаются в лиотропный ряд Гоффмейстера.
CNSֿ> Iֿ > CIֿ≈ H2O> CH3COOֿ > Fֿ> SO42–
 Способствуют набуханию Подавляют набухание
Способствуют набуханию Подавляют набухание
Анионы, подавляющие набухание, хорошо гидратируются сами, поэтому отнимают воду от гидратной оболочки макромолекул.
5) Возраст полимера влияет на набухание: чем моложе полимер, тем он больше удерживает воду. С течением времени увеличивается число и прочность связей между макромолекулами, возрастает плотность системы. Сравните молодой весенний листочек и осенний желтый лист, утративший способность к набуханию.
