Классификация используемых в контроле качества фармацевтической продукции питательных сред
1. По назначению:
? Среды общего назначения – предназначены для выращивания многих видов микроорганизмов. Могут применяться в качестве основы для приготовления специальных питательных сред
? Специальные среды – предназначены для избирательного культивирования определенных микроорганизмов, изучения их свойств и хранения.
• Селективные среды: применяют для выделения микроорганизмов из мест их естественного обитания или получения накопительных культур. Обеспечивают преимущественное развитие одного вида или группы микроорганизмов.
Избирательность достигается путем:
- Создания оптимальных условий (рН, состав питательных веществ и др.)
- Путем добавления веществ, угнетающих рост других микроорганизмов
• Дифференциально-диагностические среды: применяют для изучения биохимических свойств и дифференцирования микроорганизмов разных видов/родов по характеру их ферментативной активности. Дифференцирующие свойства достигаются путем:
- Внесения субстрата, к которому определяется отношение микроорганизмов (сахаров, аминокислот)
- Внесения соответствующих индикаторов (рН-индикаторов: фуксин, бромтимоловый синий и др.)
? Транспортные (консервирующие) среды: используются в клинической практике для сохранения жизнеспособности микроорганизмов в период от отбора пробы до посева (во время транспортировки)
2. По составу:
? Натуральные: содержат продукты животного и/или растительного происхождения, имеют неопределенный химический состав (кровь, молоко, желчь, мясной перевар растительные отвары и др.).
Нестандартные среды. Используют для поддержания культур, накопления биомассы, диагностических целей.
? Полусинтетические (искусственные): в состав входят соединения известной химической природы (неорганические и органические соли, углеводы, азотистые вещества) и вещества неопределенного состава (отвары животного и растительного происхождения).
? Синтетические: содержат только химически чистые соединения в точно указанных концентрациях, т.е. состав полностью известен.
Стандартные среды. Используют для исследования обмена веществ.
3. По консистенции:
-Жидкие
-Полужидкие (0,5 % агара)
-Плотные (1,5 – 2,0% агара)
-Сухие (влага – не более 10%)
-Сыпучие (отруби, разваренное пшено, жмых и т.д.)
4. По способу производства:
? Коммерческие: изготавливаются промышленным способом
- Готовые к применению (имеют нужную консистенцию)
- Сухие (требуют растворения в растворителе в соответствии с прилагаемой инструкцией).
Преимущества: более стандартны, процесс их приготовления строго регламентирован, качество контролируется по всем показателям
? Среды лабораторного изготовления: готовятся в лаборатории по прописям в соответствии с ГФ РБ. Преимущества: возможность внесения лабильных соединений, обеспечивающих рост требовательных микроорганизмов.
Контроль качества. Требования к проведению контроля качества фармацевтической продукции. Требования к службе контроля качества.
Контроль качества (quality control) – проведение проверок или испытаний на соответствие требованиям нормативного документа по контролю качества Контроль качества является частью GMP, которая связана с:
•отбором проб
•проведением испытаний
•организацией и документированием процедуры выдачи разрешений на реализацию, которые гарантируют, что качество продукции признано удовлетворительным.
Требования к проведению контроля качества фармацевтической продукции:
•Наличие необходимых технических средств, обученного персонала;
•Наличие утвержденных процедур по отбору проб, контролю исходных и упаковочных материалов, промежуточной, нерасфасованной продукции, мониторингу окружающей среды;
•Валидация всех методик;
•Протоколирование и исследование любых отклонений;
•Сохранение достаточного количества образцов сырья, упаковочных материалов, а также готовой продукции для того, чтобы в случае необходимости провести испытание продукции в процессе хранения. Контроль качества осуществляется силами специалистов службы (отдела) контроля качества.
Требования к службе контроля качества:
•Независимость от других подразделений;
•Должна возглавляться лицом, имеющим соответствующую квалификацию и опыт;
•Наличие аккредитованных испытательных лабораторий и ресурсов, гарантирующих, что все мероприятия по контролю качества проводятся эффективно и надежно;
•Контроль качества должен осуществляться в соответствии с утвержденными и валидированными методиками;
•Участие в решении всех вопросов, имеющих отношение к качеству продукции;
•Проверка и утверждение всех документов, имеющих отношение к качеству продукции.
Каждая серия лекарственного средства, зарегистрированного в Республике Беларусь, до поступления в реализацию подлежит проверке на соответствие требованиям нормативного документа по качеству (ФСП - для ЛС, НД по качеству – для АФИ).
Производитель лекарственного средства на каждую выпущенную серию лекарственного средства выдает документ, подтверждающий соответствие качества. Для ЛС - паспорт, для АФИ – аналитический лист. Лекарственное средство отечественного производства, не соответствующее требованиям ФСП, а также ЛС зарубежного производства, не соответствующее требованиям нормативного документа производителя, считаются некачественными.
Определение количественного содержания (активности) антибиотиков. Микробиологические методы определения активности антибиотиков: принцип, виды, общие фармакопейные подходы. Метод диффузии в агаризованную среду.
I Количественное определение антибиотиков (ГФ РБ, раздел 2.7.2)
Антибиотики(от др.-греч. ăντί — против + βίος — жизнь) — вещества природного (микробного, животного, растительного) или полусинтетического происхождения, способные подавлять рост определенных микроорганизмов или вызывать их гибель.
Антибиотики природного происхождения чаще всего продуцируются актиномицетами, низшими грибами, реже - бактериями.
Многие антибиотики оказывают сильное подавляющее действие на рост и размножение бактерий и при этом относительно мало повреждают или вовсе не повреждают клетки макроорганизма, и поэтому применяются в качестве лекарственных средств.
Некоторые антибиотики используются в качестве цитостатических (противоопухолевых) препаратов при
лечении онкологических заболеваний (доксорубицин – продуцируется Streptomyces coeruleorubidus или Streptomyces peucetius).
Количественное содержание (активность) антибиотиков является одним из основных показателей, характеризующих качество средств антимикробной терапии.
Для оценки количественного содержания антибиотиков применяют:
1. Хроматографические методы (ВЭЖХ, ТСХ);
2. Спектроскопические методы (ИК-спектроскопия, УФ- спектроскопия);
3. Биологические методы;
4. Химические методы. ВЭЖХ (HPLC - High performance liquid chromatography)
– наиболее эффективный метод анализа, который используется как для идентификации, так и контроля чистоты и количественного определения антибиотиков.
Количественное определение некоторых антибиотиков, для которых ВЭЖХ-определение затруднено, проводят микробиологическим методом.
Примером таких антибиотиков являются аминогликозиды (канамицин, гентамицин и т.д.).
Ряд антибиотиков представляют собой комплекс нескольких микробиологически активных компонентов:
капреомицин – полипептидный антибиотик,
ванкомицин – гликопептидный антибиотик.
Для них также проводится количественное определение (активность) микробиологическим методом.
Определение количественного содержания антибиотиковмикробиологическим методом основано на определении их антимикробной активности, обусловленной способностью угнетать рост чувствительных тест-микроорганизмов.
Количественно активность антибиотиков выражается в единицах действия (ЕД) или «мкг». Для большинства антибиотиков 1 ЕД или «мкг» соответствует 1 мкг активного вещества.
Активность антибиотика определяют путем сравнения степени угнетения роста чувствительного микроорганизма под действием испытуемого антибиотика и стандартного образца в известных концентрациях.
Стандартные образцы – субстанции, активность которых точно установлена по отношению к Международному стандартному образцу или Международному стандартному препарату.
Определение проводят двумя методами:
• Метод диффузии в агар
• Метод турбидиметрии
1. Метод диффузии в агар
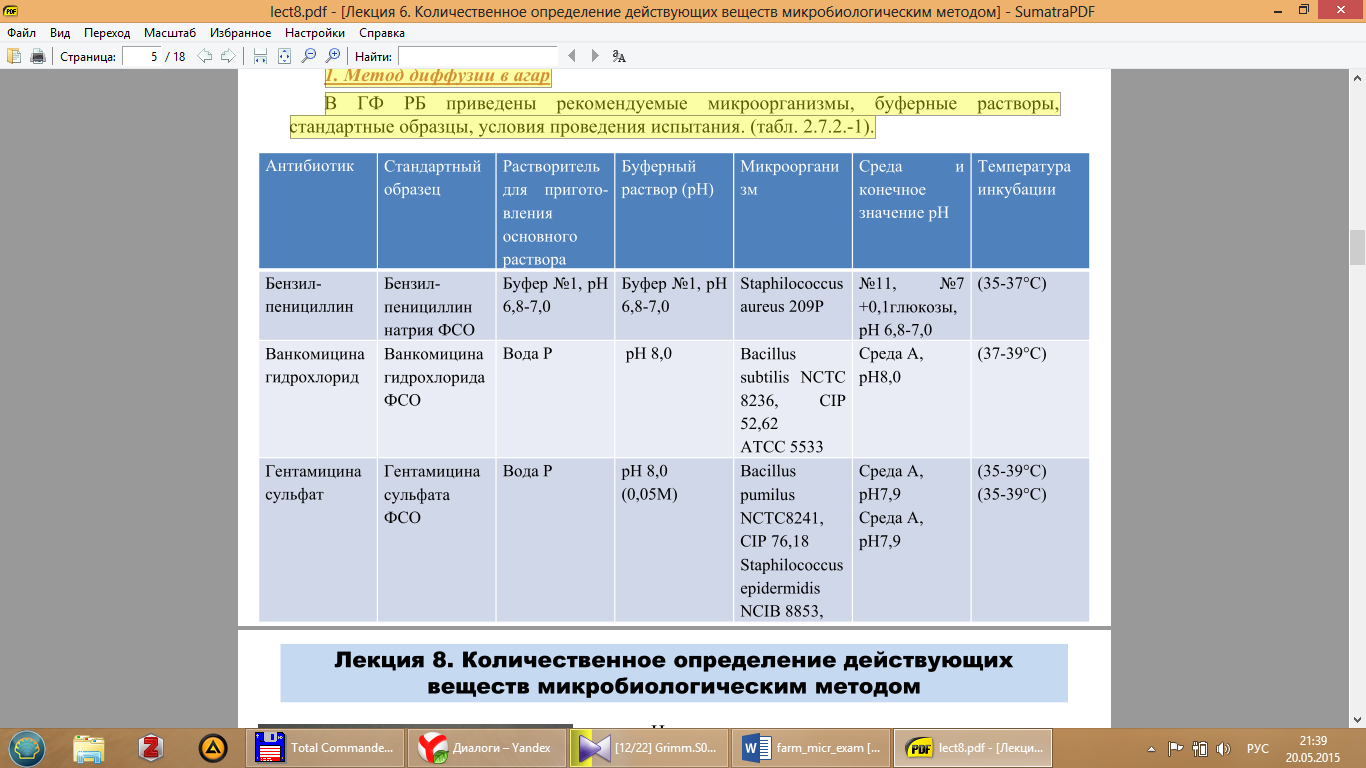
В ГФ РБ приведены рекомендуемые микроорганизмы, буферные растворы, стандартные образцы, условия проведения испытания. (табл. 2.7.2.-1).
• Питательную среду определенного состава для каждого микроорганизма расплавляют, охлаждают до (48—60)ºС для вегетативных форм и до (65—70)°С при использовании суспензии спор, засевают суспензией микроорганизмов, чувствительных к испытуемому антибиотику. Количество суспензии микроорганизмов выбирают таким образом, чтобы образовывались четко определенные зоны ингибирования.
• Инокулированная среда немедленно разливается по чашкам Петри на строго горизонтальной поверхности в количестве, достаточном для формирования однородного слоя толщиной от 2 мм до 5 мм. Среда может также состоять из двух слоев, из которых только верхний подвергался инокуляции. Поверхность среды должна быть сухой к моменту использования.
• Используя растворитель и буферный раствор, указанные в соответствующем разделе ГФ РБ, готовят основные растворы фармакопейного стандартного образца (ФСО) и испытуемого антибиотика известных концентраций (1000 мкг/мл).
• Из основных растворов готовят рабочие растворы ФСО и испытуемого образца. Для оценки достоверности количественного определения используют не менее трех доз стандартного образца и трех доз испытуемого антибиотика, имеющих равные предполагаемые активности.
Предпочтительно использовать ряды доз, меняющихся в геометрической прогрессии, например, в соотношении 1:2:4 (например, 20, 40, 80 мкг/мл).
• Растворы наносят на поверхность среды, например, в стерильных цилиндрах из фарфора, нержавеющей стали или другого подходящего материала, или в лунки, сделанные в агаре. В каждый цилиндр или лунку должны быть помещены равные объемы раствора испытуемого антибиотика и ФСО.
• Растворы испытуемого антибиотика и ФСО чередуют таким образом, чтобы исключить взаимное влияние более концентрированных растворов (т.е., чтобы растворы с большими
концентрациями не соприкасались между собой. )
Рекомендуется следующая последовательность внесения стандартного (S) и испытуемого (U) образцов в цилиндры или лунки каждой чашки:
первыми вносятся растворы стандартного и испытуемого образца с малой концентрацией (S 1 , U 1 ), затем со средней концентрацией (S 2 , U 2 ),
последними вносят растворы с большими концентрациями (S 3 , U 3 ).

S 1 и U 1 – растворы стандартного (S) и испытуемого (U) образцов с малой концентрацией (20 мкг/мл); S 2 и U 2 – со средней концентрацией (40 мкг/мл); S 3 и U 3 – с высокой концентрацией (80 мкг/мл).
• Чашки могут выдерживаться до инкубации при комнатной температуре или, если необходимо, при температуре 4°С в течение определенного промежутка времени, обычно от 1 до 4 ч для протекания диффузии.
• Чашки инкубируют при подходящей температуре около 18 ч.
• Измеряют диаметры (с точностью не ниже 0,1 мм) или площади кольцевых зон ингибирования (с
соответствующей точностью) и вычисляют активность с использованием подходящих статистических методов.
• В каждом определении используют достаточное для получения требуемой точности количество повторов. Число чашек, используемых в каждом опыте, должно быть достаточным для обеспечения статистической достоверности результатов, но не менее 6 чашек.
2. Турбидиметрический метод
• Турбидиметрия — метод количественного анализа по интенсивности света, поглощенного взвешенными частицами — клетками микроорганизмов.
Принцип:
• при добавлении определенных количеств антибиотиков наблюдается задержка роста клеток микроорганизмов (бактериостатический эффект), а затем их гибель (бактерицидный эффект). При этом изменяется (уменьшается) интенсивность поглощенного света.
Ход определения (трехдозный метод):
• Приготовление основных и рабочих растворов испытуемого антибиотика и ФСО – аналогично методу диффузии
• Помещают равные объемы каждого из растворов испытуемого антибиотика и ФСО в идентичные пробирки и прибавляют в каждую пробирку равные объемы инокулированной определенным микроорганизмом питательной среды (например, 1 мл раствора ФСО/антибиотика + 9 мл инокулированной среды)
• Контроль: 2 пробирки без антибиотика с инокулированной средой. В одну из них добавляют 0,5 мл формальдегида. Эти пробирки используют для настройки оптического прибора, используемого для измерения роста
• Все пробирки помещают случайным образом в водяную баню с температурой инкубации, оптимальной для данного штамма микроорганизма, и выдерживают 3-4 часа
• По окончании инкубации рост микроорганизмов останавливают прибавлением 0,5 мл формальдегида в каждую пробирку или тепловой обработкой и измеряют степень мутности с использованием подходящего оптического прибора
• Рассчитывают активность с использованием подходящих статистических методов
• В каждом определении используют достаточное количество повторов для получения требуемой точности
• Используемые микроорганизмы, условия их культивирования и проведения эксперимента, растворители, буферные растворы, ФСО описаны в ГФ РБ (табл. 2.7.2.-2).
Иммунобиологические лекарственные средства. Пробиотики: характеристика; фармакологические свойства; микроорганизмы, входящие в состав пробиотиков и требования к ним; классификация пробиотиков. Количественное определение живых бактериальных клеток в пробиотиках.
