Структура вещества и его свойства
Надо было исследовать предметы, прежде чем можно было приступить к исследованию процессов. Надо сначала знать, что такое данный предмет, чтобы можно было заняться теми изменениями, которые с ним происходят.
Ф. Энгельс
Характер любого химического соединения зависит не только от качественного и количественного состава, но и от взаимного
влияния атомов и строения молекулы — мельчайшей химической системы.
Вещества, имеющие одинаковую молекулярную формулу, называют изомерами,а само явление — изомерией.Формулу С4Н8O имеет 21 вещество. Долгое время вплоть до XVIII в. химики не делали различия и между минеральными и органическими веществами. Именно явление изомерии заставляет, не довольствуясь установлением молекулярной формулы, идти дальше, выясняя детали внутреннего строения молекул органических веществ, структуру соединения. Структуру молекул органических соединений пытался объяснить шведский химик Й. Берцелиус в своей теории радикалов. В ней он наивно полагает, что структура молекул зависит от электрических зарядов в молекулах органических соединений.
На смену теории радикалов пришла теория типов французского ученого Ш. Жерара, которая рассматривала органические соединения как производные простейших веществ: водорода, воды, аммиака. Формулы получались сходные с современными, но в них вкладывалось содержание совершенно иное: формулы теории типов — это только формулы превращения. Внутреннее строение молекул считали непознаваемым, становясь на позицию агностицизма — философского учения, ставящего границы человеческому познанию. "Анархия" в химии пошла на убыль благодаря работам Э. Франкланда и Ф. Кекуля. В химии утвердилось понятие о валентности, в частности развилось представление о четырехвалентности углерода. Благодаря трудам С. Канниццаро была внесена ясность в вопрос об атомных и молекулярных массах, об эквивалентах.
Таким образом, к 1860 г. было достигнуто понимание фундаментальных понятий химии (атом, молекула, эквивалент, валентность), признана справедливость закона Авогадро. Все это способствовало развитию химии в области получения веществ с заранее заданными специфическими свойствами, что являлось крупным шагом вперед. Дальнейшее развитие теория строения находит в трудах русского ученого А. М. Бутлерова. Атомы в органических молекулах связаны друг с другом в определенном
порядке химическими силами (силами валентности). Теория Бутлерова потому и названа теорией химического строения, что она указывала не на пространственное сорасположение атомов в молекуле, а на распределение действия химических сил сродства. Она указывала на причины активности одних веществ и пассивности других. Более того, она указывала на наличие активных центров и активных группировок в структуре молекулы. И именно поэтому она стала для химиков действенным руководством в практике синтеза органических веществ. Идеи об энергетической неэквивалентности химических связей, обусловленной взаимным влиянием атомов в структуре молекулы, являются главным содержанием понятия "структура" в теории Бутлерова.
Теория химического строения Бутлерова нашла физические обоснования в квантовой механике. Сегодня под структурой молекул мы понимаем и пространственную, и энергетическую упорядоченность квантово-механической системы, состоящей из атомных ядер и электронов и обладающей единой молекулярной орбиталью. Вообще же понятию "структура" в химии можно дать единое определение: структура — это устойчивая упорядоченность качественно неизменной системы, каковой является молекула. Воззрения Кекуле и Бутлерова превратили химию из науки аналитической, занимающейся изучением состава готовых веществ, в науку преимущественно синтетическую, способную создавать новые вещества и новые материалы. Пространственная структура расположения атомов в молекуле, особенно в органической химии, определяет свойства веществ и особенности химических реакций.
Структуру устанавливают физическими методами — ядерный магнитный резонанс, электронография, масс-спектрометрия и др. Формулы строения выражают порядок химической связи атомов и каждое вещество имеет одну определенную формулу строения, отражающую порядок химической связи атомов в реально существующей молекуле. Физические и химические свойства органических соединений определяются составом и строением их молекул. В то же время можно было судить лишь
о химическом строении — порядке химической связи атомов. В настоящее время имеется возможность определять пространственное строение: определять распределение электрических зарядов — электронное строение. Все три особенности строения составляют одно качественное целостное строение органического соединения. Например, формула С2НбО отвечает двум различным веществам: диметиловый эфир СН3ОСН3, этиловый спирт С2Н5ОН. Благодаря успехам химии и физики, в настоящее время знают, что химические явления связаны с процессами, происходящими в электронной оболочке атомов.
В определении строения молекулы как единой целостной системы все больше стали применять различные физико-химические методы, основанные на законах квантовой механики. К таковым относятся: рефрактометрия, спектроскопия, спектральный ядерный магнитный резонанс (ЯМР), электронный парамагнитный резонанс (ЭПР). В настоящее время разработаны методы исследования структуры и свойств химических волокон и пленок акустическим методом.
Многочисленные опыты проводятся в области зависимости структуры вещества от его биологической активности. В связи с этим заслуживает внимания новый метод количественных соотношений структура—активность (сокращенно — КССА), уже зарекомендовавший себя в фармакологии, но пригодный для поиска любых веществ с заранее заданными свойствами.
Таким образом, эволюция понятия химической структуры осуществлялась в направлении, с одной стороны, анализа ее составных частей или элементов, а с другой — установления характера физико-химического взаимодействия между ними. Последнее особенно важно для ясного понимания структуры с точки зрения системного подхода, где под структурой подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные ее свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы.
Химические процессы
О значительнейших вещах не будем судить слишком быстро.
Гераклит
Химический процесс(от лат. processus — продвижение) представляет собой последовательную смену состояний вещества, тесную связь следующих друг за другом стадий развития, представляющую непрерывное, единое движение. Учение о химических процессах — это область науки, в которой существует наиболее глубокое взаимопроникновение физики, химии и биологии. Химические процессы подразделяются на: гомо-и гетерогенные(в зависимости от агрегатного состояния реагирующих систем), экзо-и эндотермические(в зависимости от количества выделяющейся и поглощаемой теплоты), окислительные, восстановительные(в зависимости от отношения к кислороду) и др.
Все процессы, которые протекают вокруг нас, можно объединить в три большие группы.
1. Самопроизвольные процессы, которые можно использо
вать для получения энергии или совершения работы. Условиями
протекания самопроизвольных процессов или законами термо
динамики, характеризуемыми их, являются: а) в изолированной
системе, т. е. в системе, для которой исключен любой материаль
ный или энергетический обмен с окружающей средой, сумма
всех видов энергии есть величина постоянная; б) изменение
энтальпии (тепловой эффект процесса, АН) зависит только от
вида и состояния исходных веществ и продуктов и не зависит
от пути перехода. Он носит название закона Гесса и сформули
рован им в 1840 г.
2. Процессы, для осуществления которых требуется затрата
энергии или совершение работы.
3. Самоорганизация химической системы, т. е. самопроиз
вольный процесс, проходящий без изменения энергетического
запаса системы, совершается только в направлении, при котором
порядок в системе увеличивается, т. е. где энтропия уменьшается.
Способность к взаимодействию различных химических реагентов определяется не только их атомно-молекулярной структурой, но и условиями протекания химических реакций. Процесс превращения одних веществ в другие называется химической реакцией. К условиям протекания химических процессов относятся прежде всего термодинамические факторы, характеризующие зависимость реакций от температуры, давления и некоторых других условий. На скорость химической реакции также влияют следующие условия и параметры:
1) природареагирующих веществ (например, щелочные металлы растворяются в воде с образованием щелочей и выделением водорода и реакция протекает при обычных условиях моментально, а цинк, железо и другие реагируют медленно и с образованием оксидов, а благородные металлы не реагируют вообще);
2) температура. При повышении температуры на каждые 10 °С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). Со многими веществами кислород начинает реагировать с заметной скоростью уже при обыкновенной температуре (медленное окисление). При повышении температуры начинается бурная реакция (горение);
3) концентрация.Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ. Горение веществ в чистом кислороде происходит интенсивнее, чем в воздухе, где концентрация кислорода почти в 5 раз меньше. Здесь справедлив закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ;
4) площадь поверхности реагирования.Для веществ в твердом состоянии скорость прямо пропорциональна поверхности реагирующих веществ. Железо и сера в твердом состоянии реагируют достаточно быстро лишь при предварительном измельчении и перемешивании: горение хвороста и полена;
5) катализатор.Скорость реакции зависит от катализаторов, веществ которые ускоряют химические реакции, но сами при этом не расходуются. Разложение бертолетовой соли и пероксида водорода ускоряется в присутствии оксида марганца (IV) и др.
Для вступления в химическую реакцию необходимо преодолеть некоторый энергетический барьер, соответствующий энергии активации, возможность накопления которой сильно зависит от температуры. Многие реакции долгое время не могут закончиться. В таком случае говорят, что реакция достигла химического равновесия. Химическая система находится в состоянии равновесия, если выполняются следующие три условия:
1) в системе не происходит энергетических изменений ( 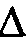 Н = 0);
Н = 0);
2) не происходит изменений степени беспорядка (,  S = 0);
S = 0);
3) не изменяется изобарный потенциал (  J = 0).
J = 0).
Вант-Тофф, используя термодинамический подход, классифицировал химические реакции, а также сформулировал основные положения химической кинетики. Химическая кинетика изучает скорости протекания химических реакций. Ле Шателье сформулировал закон смещения химического равновесия в химических реакциях под влиянием внешних факторов — температуры, давления и др. Согласно принципу Ле Шателье, если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяется температура, давление или концентрация), то положение равновесия химической реакции смещается в ту сторону, которая ослабляет данное воздействие.
Химические реакции классифицируют по изменению качества исходных веществ и продуктов реакции на следующие виды:
реакции соединения— реакции, при которых из нескольких веществ образуется одно вещество, более сложное, чем исходные;
реакции разложения— реакции, при которых из одного сложного вещества образуется несколько веществ;
реакции замещения— реакции, при которых атомы одного элемента замещают атом другого элемента в сложном веществе и при этом образуются два новых — простое и сложное;
реакции обмена— реакции, при которых реагирующие вещества обмениваются своими составными частями, в результате
чего из двух сложных веществ образуются два новых сложных вещества.
По тепловому эффекту химические реакции можно подразделить на экзотермические— с выделением теплоты и эндотермические— с поглощением теплоты. С учетом явления катализа реакции могут быть каталитические— с применением катализаторов и некаталитические— без применения катализаторов. По признаку обратимости реакции делят на обратимыеи необратимые.
В.Оствальд, исследуя условия химического равновесия, пришел к открытию явления катализа. Оказалось, что в большой степени характер и особенно скорость реакций зависят от кинетических условий, которые определяются наличием катализаторов и других добавок к реагентам, а также влиянием растворителей, стенок реактора и иных условий. Явление катализа— селективного ускорения химических процессов в присутствии веществ (катализаторов), которые принимают участие в промежуточных процессах, но регенерируются в конце реакции, широко используется в промышленности, например фиксация азота и водорода, контактный способ производства серной кислоты и многие другие. Впервые синтез аммиака был осуществлен в 1918 г. на основе работ Габера, К. Боша и А. Митташа с помощью катализатора, представляющего собой металлическое железо с добавками окисей калия и алюминия, при температуре 450-550 °Си давлении 300-1000 атмосфер. В настоящее время большое внимание уделяют применению металлоорганических и металлокомплексных катализаторов, отличающихся высокими селективностью и избирательностью действия. Тот же самый процесс синтеза аммиака при использовании металлоорганического катализатора удалось осуществить при обычной температуре (18 °С) и нормальном атмосферном давлении, что открывает большие перспективы в производстве минеральных азотных удобрений. Особенно велика роль катализа в органическом синтезе. Крупнейшим успехом в этом направлении надо признать получение искусственного синтетического каучука из этилового спирта, осуществленное советским академиком С. В. Лебедевым в 20-х годах XX века.
Ферменты, или биокатализаторы, играют исключительную роль в биологических процессах и технологии веществ растительного и животного происхождения, а также в медицине. В настоящее время известно свыше 750 ферментов, и их число ежегодно увеличивается. Ферменты являются бифункциональными и полифункциональными катализаторами, так как здесь имеет место согласованное воздействие двух или нескольких групп катализаторов различной природы в составе активного центра фермента на поляризацию определенных связей субстрата. Эта же концепция лежит в основе каталитического действия фермента и теории кинетики действия ферментов. Главное отличие ферментов от других катализаторов заключается в исключительно высокой активности и ярко выраженной специфичности.
Самоорганизация химических систем в биологические, их единство и взаимосвязь подтверждает синтез органических соединений из неорганических. В 1824 г. немецкий химик Ф. Велер, ученик Берцелиуса, впервые получил из неорганического дициана N-C-C-N при нагревании его с водой щавелевую кислоту НООС-СООН — органическое соединение. Также было получено новое органическое вещество — мочевина (карбамид) из цианистого аммония. В 1854 г. во Франции М. Бертло синтетическим путем получил жир. Наибольшим успехом химии 50-60-х гг. XX в. явился первый синтез простых белков — гормона инсулина и фермента рибонуклерозы.
