Усовершенствование технологии ПЦР
С.В. Поспелова, М.В. Кузнецова
Полимеразная цепная реакция
Методические рекомендации
Пермь 2007
УДК 616-078.33
ББК 53.4
Авторы:
С.В. Поспелова – канд. мед. наук, доцент кафедры микробиологии, вирусологии и иммунологии, М.В. Кузнецова – канд. биол. наук, сотрудник ИЭГМ УрО РАН
Поспелова, С.В.
Полимеразная цепная реакция: метод. рекомендации / С.В. Поспелова, М.В. Кузнецова; ГОУ ВПО ПГМА
им. ак. Е.А. Вагнера Росздрава. – Пермь, 2007. – 35 с.
Предназначены для самостоятельной работы студентов всех факультетов: лечебного, педиатрического, медико-профилактического, стоматологического и факультета высшего сестринского образования (ФВСО) медицинской академии.
Рецензент:
зав. кафедрой биологии, экологии и медицинской генетики ПГМА, профессор А.Б. Виноградов
Печатается по решению центрального координационного
методического совета ГОУ ВПО ПГМА
им. ак. Е.А. Вагнера Росздрава
УДК 616-078.33
ББК 53.4
© Поспелова С.В., Кузнецова М.В., 2007
© ГОУ ВПО ПГМА им. ак. Е.А. Вагнера Росздрава, 2007
Полимеразная цепная реакция в клинической
микробиологической диагностике
Современная медицина успешно использует достижения естественных наук, интенсивно применяет новые технологии для диагностики и лечения заболеваний. В последнее время к традиционным микробиологическим и иммунологическим методам лабораторной диагностики инфекционных заболеваний добавились новые, основанные на использовании молекулярно-генетических технологий. Применение этих методов не только в научных целях, но и в практической лабораторной диагностике стало возможным в немалой степени благодаря созданию в середине 80-х годов процесса искусственного многократного копирования ДНК и дальнейшему стремительному развитию этой технологии, в настоящее время известной как полимеразная цепная реакция (ПЦР). Менее чем за 15 лет своего существования ПЦР сделала рутинным анализ специфических ДНК-последовательностей многих патогенных микроорганизмов. Универсальность, высокая чувствительность и относительная простота исполнения сделали метод ПЦР незаменимым для решения различных задач клинической диагностики, таких как прямое обнаружение и идентификация возбудителей заболеваний, молекулярное типирование и исследование свойств патогенных микроорганизмов, анализ мутаций, связанных с генетическими заболеваниями у человека, идентификация личности человека.
Что такое ПЦР?
Полимеразная цепная реакция (ПЦР) - искусственный процесс многократного копирования (амплификации) специфической последовательности ДНК, осуществляемый in vitro (рис. 1). Копирование ДНК при ПЦР осуществляется специальным ферментом - ДНК-полимеразой, как и в клетках живых организмов. ДНК-полимераза, двигаясь по одиночной цепи ДНК (матрице), синтезирует комплементарную ей последовательность ДНК. Важно, что ДНК-полимераза не может начать синтез цепи ДНК «с нуля», ей необходима короткая «затравочная» цепь РНК или ДНК, к которой она может начать присоединять нуклеотиды. Основной принцип ПЦР состоит в том, что реакция полимеризации (синтеза полимерной цепи ДНК из мономерных нуклеотидных звеньев) инициируется специфическими праймерами (короткими фрагментами «затравочной» ДНК) в каждом из множества повторяющихся циклов. Специфичность ПЦР определяется способностью праймеров «узнавать» строго определенный участок ДНК и связываться с ним согласно принципу молекулярной комплементарности.
В обычной реакции ПЦР используется пара праймеров, которые «ограничивают» амплифицируемый участок с двух сторон, связываясь с противоположными цепями ДНК-матрицы. Для многократного увеличения количества копий исходной ДНК нужна цикличность реакции. Как правило, каждый из последовательно повторяющихся циклов ПЦР состоит из трех этапов:
1) денатурации, или «плавления» двуцепочечной ДНК: перед началом реакции ДНК-мишень является двуцепочечной, при температуре 94-950 С комплиментарные цепи ДНК расходятся - переходят в одноцепочечное состояние;
2) связывания (отжига) праймеров: при температуре, оптимальной для выбранных праймеров, происходит их связывание с комплиментарным участком матричной ДНК;
3) элонгации, или удлинения цепи: ДНК-полимераза присоединяет нуклеотиды к праймерам, синтезируя новые цепи ДНК, которые становятся мишенью для праймеров в последующих циклах ПЦР.
Смена этапов каждого цикла осуществляется путем изменения температуры реакционной смеси (см. рис. 1).
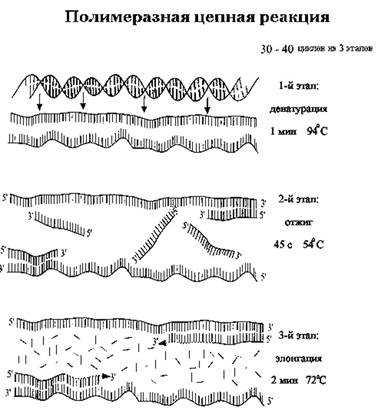
Рис. 1. Основные этапы цикла ПЦР
Сначала праймеры могут связаться только с определенной последовательностью исходной ДНК, но в последующих циклах они связываются с копиями этой последовательности, синтезированными в предыдущих циклах. При этом количество основного продукта ПЦР (копии последовательности ДНК, ограниченной праймерами) теоретически удваивается в каждом цикле. Если на начальном цикле в исследуемом материале была только одна ДНК-мишень, после первого цикла будет уже две копии, после двух циклов – 4 копии, результатом третьего цикла будет 8 копий, а тридцать пятого – уже 68 биллионов копий (рис. 2).
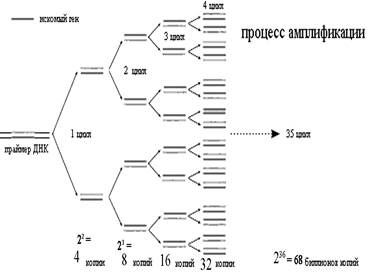
Рис. 2. Процесс многократного копирования
ДНК-мишени в ходе последовательно
сменяющихся циклов
Основным методом анализа продуктов реакции, который традиционно применяется во многих лабораториях для обнаружения амплифицированной ДНК и определения ее размера, является метод гель-электрофореза с последующим окрашиванием красителем, специфичным к ДНК, например бромистым этидием (рис. 3).
Контроль – различные фрагменты ДНК с известным количеством составляющих их нуклеотидов. Известно, что дистанция между различными фрагментами имеет логарифмическую зависимость от их размера, массы. Линия 1 – обнаружены ПЦР-фрагменты длиной приблизительно 1850 оснований. Линия 2 и 4 – фрагменты длиной около 800 оснований.
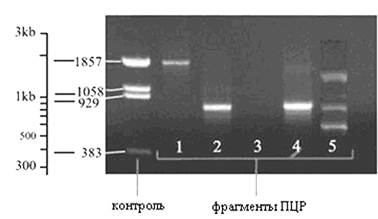
Рис. 3. Анализ продуктов реакции методом
гель-электрофореза
Линия 3 – не выявлены искомые фрагменты, отрицательный результат реакции. Линия 5 – множественные линии сформировались потому, что праймеры оказались комплиментарны к нескольким фрагментам ДНК различной длины: около 550, 800 и 1500 оснований.
Усовершенствование технологии ПЦР
Первоначально для осуществления ПЦР использовали обычные ДНК-полимеразы, которые подвергались температурной инактивации в каждом цикле на этапе денатурации ДНК. Полимеразу приходилось многократно добавлять в реакционную смесь, что было довольно трудоемко и не позволяло автоматизировать процесс.
В реакции используются термостабильные ДНК-полимеразы, выдерживающие высокую температуру на всех этапах цикла ПЦР в течение нескольких десятков циклов. Количество коммерчески доступных термостабильных ДНК-полимераз, отличающихся некоторыми своими свойствами, достаточно велико. Наиболее часто используется Taq-полимераза, первоначально выделенная из термофильного микроорганизма Thermus aquaticus. Другие полимеразы чаще применяются для особых приложений ПЦР. Современные коммерческие препараты термостабильных полимераз обеспечивают, как правило, стабильную воспроизводимую активность, что позволяет использовать технологию ПЦР в стандартной лабораторной практике.
Техническое оформление смены температуры реакционной смеси также стремительно развивалось в последнее время. Сначала ПЦР осуществлялась при помощи трех водяных бань, настроенных на разную температуру: для денатурации ДНК, отжига праймеров и полимеризации. Пробирки переносились из одной водяной бани в другую «по кругу», благодаря чему происходила смена температуры на разных этапах цикла. Существовали и варианты приборов, где в водяную баню, в которой находились пробирки с реакционной смесью, поочередно подавалась вода разной температуры. Смена циклов в этих случаях занимала много времени, и процесс плохо поддавался автоматизации. Для осуществления ПЦР в основном используются приборы (термоциклеры), которые изменяют температуру автоматически на основе заданной программы. В термоциклерах пробирки с реакционной смесью помещаются в металлический блок, температура которого изменяется с большой скоростью, что сокращает продолжительность каждого цикла ПЦР.
Современные термоциклеры приспособлены для использования специальных тонкостенных пластиковых пробирок для реакционной смеси, что позволяет ускорить теплообмен между блоком прибора и реакционной смесью и в конечном итоге дополнительно сократить время проведения реакции.
Таким образом, стандартная ПЦР может быть осуществлена за 1-3 ч. Многие приборы позволяют программировать специальные усложненные температурные профили, необходимые для специфических модификаций процесса ПЦР.
Параллельно с усовершенствованием технологии ПЦР развивались и методы анализа продуктов реакции. Метод гель-электрофореза с последующим окрашиванием красителем, специфичным к ДНК, например бромистым этидием, традиционно применяется во многих лабораториях для обнаружения амплифицированной ДНК и определения ее размера. Использование гибридизации с внутренними ДНК-зондами позволяет в ряде случаев значительно повысить чувствительность и специфичность детектирования ПЦР-продуктов. Благодаря отсутствию необходимости в подготовке и проведении электрофоретического разделения, возможности автоматизации для анализа большого количества образцов и использования нерадиоактивного формата детектирования, этот метод становится все более распространенным. В некоторых случаях применение специальных флюоресцентных «маркеров» позволяет контролировать проведение амплификации или детектирование конечных продуктов ПЦР непосредственно в реакционной пробирке.
Использование ПЦР
в медицинской микробиологии
Среди множества различных направлений клинической диагностики медицинская микробиология занимает, пожалуй, лидирующее место по количеству и разнообразию приложений, использующих технологию ПЦР. Внедрение в практику этого метода наряду с серологической диагностикой существенно расширило возможности современной клинической микробиологии, основу которой до сих пор составляют методы выделения и культивирования микроорганизмов на искусственных питательных средах или в культуре клеток.
Возможности и ограничения традиционных
методов культивирования
Традиционный для микробиологических лабораторий культуральный метод диагностики, как правило, хорошо оправдывает себя для выявления и исследования таких свойств, как чувствительность к антибиотикам, вирулентность легкокультивируемых микроорганизмов. Однако некоторые микроорганизмы (пневмококки, гемофилы, нейссерии, микоплазмы, облигатные анаэробы и др.) могут быть чрезвычайно чувствительными к условиям забора клинического материала, транспортировки и культивирования, наличию специальных факторов роста или способны к размножению in vitro только в культуре клеток (вирусы, хламидии, риккетсии).
Медленный рост на искусственных средах таких микроорганизмов, как микобактерии и грибы, является еще одним естественным ограничением, связанным с использованием культурального метода для диагностики этих микроорганизмов. Кроме того, работа с живыми культурами выделенных возбудителей, причем не только особо опасных, но иногда и условно-патогенных, может представлять угрозу для здоровья персонала лаборатории.
Среди возбудителей болезней человека известны также и некультивируемые виды бактерий, например Mycobacterium leprae, Treponema pallidum, и многие виды вирусов, включая вирусы папилломы человека и гепатита С, попытки выращивания которых в клеточной культуре пока остаются безуспешными. Наконец, даже при успешном культивировании существует необходимость последующей идентификации выделенных микроорганизмов.
Традиционные микробиологические методы идентификации основаны на использовании различных фенотипических тестов, таких как выявление специфической ферментативной активности, способности метаболизировать сахара или поддерживать рост на средах с селективными добавками. Сложность стандартизации условий подобных тестов, а также естественная фенотипическая вариабельность, присущая многим микроорганизмам, могут быть причиной неправильной идентификации.
Использование ПЦР для прямой диагностики
и идентификации возбудителей
инфекционных заболеваний
В тех случаях, когда использование культуральных методов является проблематичным или связано с недостаточной диагностической эффективностью, возможность замены биологической амплификации (то есть роста на искусственных средах) на ферментативное удвоение нуклеиновых кислот in vitro с помощью ПЦР представляется особенно привлекательной. Существуют различные подходы к использованию ПЦР для диагностики возбудителей инфекций. Наиболее распространенный вариант ПЦР (specific PCR) предусматривает использование праймеров, комплементарных специфической последовательности ДНК, характерной для строго определенного вида микроорганизма. Например, ПЦР-амплификация специфического участка гена, кодирующего главный белок наружной мембраны (МОМР) Chlamydia trachomatis, в сочетании с нерадиоактивной гибридизацией для детектирования продуктов реакции позволяет обнаружить единичные копии хламидийной ДНК в исследуемых образцах. При этом ПЦР значительно превосходит по диагностической эффективности культивирование и методы прямого обнаружения хламидийного антигена (микроиммунофлюоресценцию и иммуноферментный анализ), традиционно используемые для выявления С. trachomatis.
Имеется также возможность использования сразу нескольких пар видоспецифических праймеров в одной реакционной пробирке для одновременной амплификации ДНК различных возбудителей. Такая модификация получила название множественной ПЦР (multiplex PCR). Множественная ПЦР может быть использована для выявления этиологической роли различных микроорганизмов, вызывающих заболевания определенного типа. Так, например, описаны варианты применения множественной ПЦР для одновременного обнаружения двух (С. trachomatis и N. gonorrhoeae при заболеваниях урогенитального тракта) или даже четырех возбудителей (И. influenzae, S. pneumoniae, M. catarrhalis и A. otitidis при хроническом гнойном отите).
Альтернативный подход в ПЦР-диагностике связан с использованием универсальных праймеров, которые позволяют амплифицировать фрагменты генов, присутствующих у всех микроорганизмов определенной таксономической группы. Количество видов, которые могут быть выявлены с помощью этого метода, может ограничиваться как рамками небольших систематических групп (рода, семейства), так и крупных таксонов на уровне порядка, класса, типа. В последнем случае мишенью для ПЦР чаще всего являются рибосомные гены (16S и 23S рРНК), которые имеют сходную структуру у различных прокариотических микроорганизмов.
Использование праймеров, комплементарных консервативным участкам этих генов, позволяет амплифицировать ДНК большинства видов бактерий. Полученные в результате ПЦР фрагменты рибосомных генов могут быть затем проанализированы с помощью различных лабораторных методов с целью идентификации бактерий, которым они принадлежат. Наиболее точным методом «молекулярной» идентификации является определение полной нуклеотидной последовательности (секвенирование) амплифицированной ДНК и сравнение ее с соответствующими последовательностями известных видов.
Несмотря на наличие автоматизированных систем, использующих описанный принцип идентификации, на практике обычно используются менее трудоемкие и дорогостоящие методы, которые тем не менее позволяют достоверно выявлять определенные различия в последовательности ДНК-фрагментов. Наиболее распространенными являются методы, основанные на анализе расположения в ДНК участков расщепления ферментами-рестриктазами (метод ПДРФ (RFLP) – полиморфизм длины рестрикционных фрагментов), или на определении электрофоретической подвижности ДНК в одноцепочечной форме (метод SSCP-одноцепочечный конформационный полиморфизм).
ПЦР с использованием универсальных праймеров может применяться как для идентификации выделенных в чистой культуре микроорганизмов, так и для прямой диагностики широкого спектра возбудителей непосредственно в клинических образцах. Следует однако отметить, что чувствительность ПЦР «широкого спектра», как правило, ниже по сравнению с «видоспецифическими» тест-системами. Кроме того, ПЦР с универсальными праймерами обычно не используется для исследования образцов, в которых может находиться большое количество различных микроорганизмов, из-за трудности анализа продуктов реакции, полученных в результате амплификации ДНК разных видов.
Методы молекулярного типирования
микроорганизмов на основе ПЦР
ПЦР широко используется не только для диагностики и идентификации, но и для субвидового типирования и анализа генетического родства (клональности) выделенных штаммов микроорганизмов, особенно при проведении эпидемиологических исследований. По сравнению с традиционными фенотипическими методами (био-, фаго- и серотипированием) генотипирование на основе ПЦР отличается универсальностью, более глубоким уровнем дифференциации, возможностью использования количественных методов для оценки идентичности штаммов и высокой воспроизводимостью. Описано много методов генотипирования, которые можно рассматривать как производные технологии ПЦР.
Несмотря на разнообразие методов ПЦР-типирования, общим для большинства из них является использование гель-электрофореза для разделения фрагментов ДНК разной длины, полученных от каждого отдельного штамма. При этом сравнительный анализ индивидуальных электрофоретических профилей, проводимый визуально или с помощью компьютера, позволяет оценить степень генетического родства исследуемых штаммов.
Использование ПЦР для выявления лекарственной
устойчивости у микроорганизмов
В последнее время ПЦР все чаще используется для исследования различных свойств патогенных микроорганизмов, в частности для выявления устойчивости отдельных видов возбудителей к определенным лекарственным препаратам. Как правило, использование ПЦР для определения чувствительности микроорганизмов является целесообразным лишь в тех случаях, когда традиционные фенотипические методы неприменимы или недостаточно эффективны. Например, определение чувствительности Mycobacterium tuberculosis к противотуберкулезным препаратам с помощью культуральных методов занимает обычно от 4 до 8 нед. Кроме того, результаты фенотипических тестов в подобных случаях могут быть искажены в связи со снижением активности антимикробных препаратов в процессе длительного культивирования микроорганизмов. Исследование молекулярных механизмов лекарственной устойчивости М. tuberculosis и некоторых других возбудителей позволило разработать методы на основе ПЦР для быстрого выявления генетических маркеров резистентности.
Для подобного анализа обычно используется ДНК или РНК возбудителя, выделенного в чистой культуре. Однако в некоторых случаях имеется возможность прямого ПЦР-анапиза на антибиотикорезистентность без предварительного культивирования возбудителя. Исследуемый образец клинического материала при этом используется как источник ДНК-мишени для ПЦР, а откопированный ПЦР-продукт подвергается анализу с целью выявления мутаций, связанных с антибиотикорезистентностью. Разработан, например, метод, позволяющий с помощью ПЦР обнаружить у пациентов, страдающих туберкулезным менингитом, устойчивость возбудителя к рифампицину.
Существуют, однако, естественные ограничения для использования генетических методов оценки лекарственной устойчивости микроорганизмов:
• данные о конкретных генетических механизмах резистентности могут отсутствовать;
• резистентность к определенным препаратам часто бывает связана с различными механизмами и мутациями в различных генах, которые независимо влияют на фенотип.
Например, резистентность грамотрицательных бактерий к аминогликозидным антибиотикам может быть вызвана продукцией различных аминогликозидмодифицирующих ферментов или изменением проницаемости клеточной стенки. В этом случае результаты ПЦР-анализа, который всегда характеризует строго определенный специфический участок ДНК, не могут служить основанием для оценки чувствительности микроорганизма в целом.
Кроме того, отсутствие международных стандартов и рекомендаций по использованию ПЦР для определения чувствительности к антимикробным препаратам является дополнительным фактором, ограничивающим возможность широкого применения этого подхода в практической диагностике.
