Бактериологические методы исследования. выделение чистых культур бактерий
ЗАНЯТИЕ 1
▲ План
▲ Программа
1. Метаболизм аэробных и анаэробных бактерий.
2. Питательные среды, применяемые для культивирования: их типы, компоненты сред и роль отдельных ингредиентов в жизнедеятельности различных микроорганизмов.
3. Понятие о чистой культуре и методы ее выделения; I этап выделения чистой культуры.
4. Особенности культивирования анаэробов, специальные питательные среды.
▲ Демонстрация
1. Выпускаемые промышленностью образцы питательных сред.
2. Готовые питательные среды в разных формах: мясо-пептонный агар (МПА) в чашке Петри, столбик и скошенный агар; мясопептонный бульон (МПБ) в пробирке; сахарный бульон в пробирке и в колбе; кровяной агар в чашке Петри; среда Китта—Тароцци в пробирке; среда Вильсона—Блера (железосульфитный агар) в пробирке; молоко в пробирке; тиогликолевый агар в пробирке; трубка Вейнберга с агаром; анаэрос-тат.
3. Техника посева исследуемого материала петлей и шпателем на чашку Петри с плотной питательной средой с целью получения изолированных колоний.

 А Задание студентам
А Задание студентам
1.Ознакомиться с питательными средами и основными ингредиентами для их изготовления.
2. Выполнить I этап выделения чистой культуры аэробов из исследуемого материала, содержащего смесь бактерий:
а) приготовить мазок из исследуемого материала и
окрасить его по методу Грама, микроскопировать,
оценить морфологию присутствующих бактерий и
их концентрацию;
б) засеять материал на чашку Петри с МПА, нанося
материал петлей и последовательно распределяя его
шпателем;
в) наметить ход дальнейшего исследования по выде
лению чистых культур аэробных бактерий.
ЗАНЯТИЕ 2
Программа
1. IIэтап выделения чистых культур аэробных бактерий.
2. Особенности культивирования анаэробов; характер роста анаэробов на специальных питательных средах.
Демонстрация
1. Различные типы колоний аэробных бактерий.
2. Рост чистых культур анаэробов на средах Китта—Та-роцци, Вейнберга, Вильсона—Блера, молоке и тио-гликолевом бульоне.
3. Техника отсева культуры из колоний на скошенный агар.
А Задание студентам
1. Выполнить II этап выделения чистой культуры аэро
бов из материала, содержащего смесь бактерий:
а) учесть результаты посева исследуемого материала
на чашке Петри с МПА, отметить наличие или
отсутствие колоний, в случае неудачи проанализи
ровать ее причины;
б) определить, сколько типов колоний имеется на
чашке, и зарисовать их;
в) описать по принятой схеме колонии всех типов;
г) приготовить мазки из колоний каждого типа и ок
расить их по методу Грама, микроскопировать и
занести данные в протокол;
д) произвести отсев чистой культуры из колонии каж
дого типа на скошенный агар;
е) наметить план дальнейшей работы.
2. Составить план выделения чистой культуры анаэро
бов.
А Методические указания
Основные среды.Пептонный бульон. Выпускается в сухом виде; состав (г/л): триптический гидролизат кильки — 10,05; натрия хлорид — 4,95.
Питательный агар. Состав (г/л): ферментативный гидролизат кормовых дрожжей — 12,0; агар — 12,5; натрия хлорид - 5,5; рН 7,3+0,1.
Основные сложные среды —кровяные, сывороточные и асцитические. Их готовят путем добавления к питательному агару 5—10 % дефибринированной крови или сыворотки крови либо 25 % асцитической жидкости. Для приготовления жидкой среды такие же количества сыворотки или асцитической жидкости добавляют к питательному бульону.
Агар Мюллера-Хинтон (основная плотная питательная среда для определения чувствительности бактерий кантибиотикам методом дисков): на 1 л дистиллированной воды 300 г мясного настоя (из говядины), 17,5 г гидролизата казеина, 1,5 г крахмала, 17 г агар-агара.
Элективные питательные среды.Пептонная вода 1 %, рН 8,0. Избирательная для холерного вибриона, который размножается быстро, опережая рост других микроорганизмов. Щелочная реакция среды не препятствует росту возбудителя холеры Vibrio cholerae, но тормозит рост других микроорганизмов.
Щелочной агар (плотная среда): питательный агар, рН 7,8, аналогично предыдущей среде элективен для V.cholerae.
Среда Леффлера. Смесь 1 части лошадиной сыворотки и 3 частей сахарного бульона, скошенная в пробирках при нагревании в аппарате Коха, элективна для возбудителя дифтерии Corynebacterium diphtheriae.
Желточно-солевой агар (ЖСА). Содержит повышенные концентрации хлорида натрия (8—10 %), которые не препятствуют размножению стафилококков, что обеспечивает элективность среды для данных микроорганизмов. Среда позволяет дифференцировать стафилококки, продуцирующие ле-цитиназу, от стафилококков, не выделяющих этот фермент, по образованию зон помутнения с перламутровым оттенком вокруг колоний лецитиназоположительных видов (фермент расщепляет лецитин куриного желтка, который вносится в расплавленный и остуженный до 45 °С питательный солевой агар).
Среды длякультивирования анаэробов. Среда Вильсона—Блера (железосульфитный агар). Готовится из питательного агара, к которому добавляют глюкозу, Na2S03, FeCl2. Анаэробные клостридии (C.perfringens) на этой среде образуют колонии черного цвета за счет восстановления Na2S03 в Na2S, который, соединяясь с хлоридом железа, дает осадок сульфида железа (FeS) черного цвета.
 Среда Китта —Тароцци. Состоит из питательного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают в течение 10—15 мин на кипящей водяной бане для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла.
Среда Китта —Тароцци. Состоит из питательного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают в течение 10—15 мин на кипящей водяной бане для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла.
Тиогликолевый бульон с гемином (жидкая элективная среда для культивирования неспорообразующих анаэробов — представителей родов Bacteroides, Prevotella, Porphyro-monas): на 1 л дистиллированной воды 17 г гидролизата казеина, 3 г соевого гидролизата, 6 г глюкозы, 2,5 г хлорида натрия, 0,5 г тиогликолата натрия, 0,25 г L-цистеина, 0,1 г сульфата натрия, 5 мг гемина.
Дифференциально-диагностические среды.Среды Гисса. К 1 % пептонной воде добавляют 0,5 % раствор определенного углевода (глюкоза, лактоза, мальтоза, маннит и др.) и индикатор Андреде (кислый фуксин в 1 н. растворе NaOH), разливают по пробиркам. В пробирки помещают поплавок (трубка длиной около 3 см, один конец которой запаян) для улавливания газообразных продуктов, образующихся при разложении углеводов. Среда при рН 7,2—7,4 бесцветна. При разложении углеводов она приобретает красный цвет.
Среда Ресселя. Применяется при изучении биохимических свойств энтеробактерий (шигелл, сальмонелл). Содержит питательный агар, лактозу, глюкозу и индикатор бромти-моловый синий. Приготавливают в пробирках по 6—8 мл в виде столбика со скошенной поверхностью. Цвет незасеянной среды травянисто-зеленый. Посев делают штрихом по скошенной поверхности и уколом в глубину столбика. Микроорганизмы, ферментирующие глюкозу до кислоты, вызывают изменение окраски столбика среды из первоначальной травянисто-зеленой в желтую; скошенная поверхность при этом приобретает синий цвет. Лактозоположительные микроорганизмы (Е. coli) изменяют цвет столбика и скошенной части среды в желтый. Микроорганизмы, образующие щелочь, изменяют цвет среды в синий. Газообразование отмечается в толще столбика среды.
Среда Эндо. Выпускается в виде порошка, который состоит из высушенного питательного агара с 1 % лактозы и индикатора — основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или бледно-розовая. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные бактерии образуют бесцветные колонии.
Среда Плоскирева (бактоагар Ж). Выпускается в сухом виде и содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Эта среда явля-
ется не только дифференциально-диагностической, но и селективной, так как подавляет рост многих микроорганизмов (кишечная палочка и др.) и способствует лучшему росту некоторых патогенных бактерий (возбудители брюшного тифа, пара-тифов, дизентерии). Лактозоотрицательные бактерии образуют на этой среде бесцветные колонии, а лактозоположительные — красные.
Висмут-сульфит агар. Выпускается в сухом виде; содержит триптический гидролизат кильки, глюкозу, неорганические соли, бриллиантовый зеленый, агар. Среда предназначена для выделения сальмонелл. Дифференцирующие свойства среды основаны на способности микроорганизмов продуцировать H2S, который вступает в реакцию с цитратом висмута и образует соединение черного цвета — сульфит висмута. Среда резко угнетает рост сопутствующей микрофлоры за счет инги-бирующего действия бриллиантового зеленого и сульфита натрия.
Техника посевов и пересевов культур микроорганизмов.Универсальным инструментом для производства посевов является бактериологическая петля (металлическая многоразовая или пластмассовая одноразовая). Кроме нее, для посева уколом применяют специальную бактериологическую иглу, а для посевов на чашки Петри — металлические, стеклянные или пластиковые шпатели. Для посевов жидких материалов наряду спетлей используют пастеровские и градуированные пипетки. Первые предварительно изготовляют из стерильных легкоплавких стеклянных трубочек, которые вытягивают на пламени в виде капилляров. Конец капилляра сразу же запаивают для сохранения стерильности. У пастеровских и градуированных пипеток широкий конец закрывают ватой, после чего их помещают в специальные пеналы или обертывают бумагой и стерилизуют.
Все манипуляции с микробами осуществляют с помощью стерильных инструментов вблизи пламени горелки. Металлическую бактериологическую петлю перед использованием, после каждой манипуляции и по окончании работы стерилизуют путем прокаливания в пламени горелки.
Культивирование микробов осуществляют посевом их на питательные среды с последующей инкубацией в оптимальных условиях температуры, влажности, газового состава атмосферы и т.д. С этой целью материал, содержащий микроорганизмы (материал от больного, из чистой культуры, из изолированной колонии и т.д.), помещают (засевают) в жидкие или на плотные среды. В последнем случае посев может быть произведен как на поверхность, так и в глубину агара уколом. Предварительно посуду (пробирку, чашки Петри и др.) надписывают, указывая дату посева и характер посевного материала (номер исследования или название культуры). В зависимости от техники посева
 и концентрации микробов в посевном материале бактерии на поверхности плотной питательной среды могут давать равномерный сплошной рост — бактериальный газон, "сливной рост" (возникает при помещении большого количества микроорганизмов на ограниченный участок поверхности агара) или образовывать изолированные колонии.
и концентрации микробов в посевном материале бактерии на поверхности плотной питательной среды могут давать равномерный сплошной рост — бактериальный газон, "сливной рост" (возникает при помещении большого количества микроорганизмов на ограниченный участок поверхности агара) или образовывать изолированные колонии.
Техника посева материала на плотную питательную среду.Получение изолированных колоний. Образование изолированных колоний достигается путем механического разобщения микробов при посеве. С этой целью материал, взятый петлей, наносят на поверхность агара параллельными штрихами, чем достигается последовательное уменьшение концентрации бактерий вплоть до единичных клеток. Для снижения концентрации бактерий можно также зигзагообразными движениями густо нанести материал на небольшой участок агара в верхней части чашки Петри, после чего петлю стерилизуют, а материал распределяют параллельными штрихами по остальной части среды.
Другой способ состоит в приготовлении суспензии с малой концентрацией бактерий. Одну каплю такой суспензии наносят петлей на поверхность питательного агара в чашку Петри и тщательно втирают стерильным шпателем в среду, равномерно распределяя материал по всей ее поверхности.
Получение бактериального газона. Посевы "газоном" производят шпателем на питательный агар в чашке Петри. Для этого, приоткрыв левой рукой крышку, петлей или пипеткой наносят посевной материал на поверхность питательного агара. Затем проводят шпатель через пламя горелки, остужают его о внутреннюю сторону крышки и растирают материал по всей поверхности среды. После инкубации посева появляется равномерный сплошной рост бактерий.
Получение сливного роста. В пробирку со скошенным агаром вносят петлю с посевным материалом, опуская ее до конденсата в нижней части среды, и зигзагообразным движением распределяют материал по скошенной поверхности агара. Вынув петлю, обжигают край пробирки и закрывают ее пробкой. Петлю стерилизуют в пламени горелки и ставят в штатив.
Техника стерильной работы с пробиркой и бактериологической петлей описана в теме 2.1.
Выделение чистых культур бактерий (ЧК)
Iэтап — получение изолированных колоний бактерий из исследуемого материала. При выделении ЧК бактерий из испытуемого материала первоначально необходимо оценить концентрацию бактерий в материале. На I этапе выделения ЧК также осуществляют первоначальную идентификацию бактерий по морфологии и тинкториальным свойствам. Для решения этих задач из исследуемого материала
готовят фиксированный мазок, окрашивают по методу Грама (или другими методами в зависимости от цели исследования) и микроскопируют. Если количество бактерий в поле зрения велико, исследуемый материал разводят в пробирке со стерильным изотоническим раствором хлорида натрия. При малом количестве бактерий в препарате весь объем образца засевают на жидкие среды обогащения с целью увеличения концентрации бактерий. При необходимости выделения определенного вида бактерий посев осуществляют на элективные среды.
Для выделения ЧК бактерий из испытуемого материала необходимо сначала разобщить находящиеся в нем микробы разных видов. Обычно для этого посев материала производят на плотную питательную среду таким образом, чтобы получить изолированные колонии присутствующих в нем бактерий (см. выше). После посева чашку переворачивают дном кверху, подписывают и помещают в термостат при 37 °С на 18—24 ч.
Иногда применяют метод пластинчатых разводок, который заключается в перемешивании различных разведений исследуемого материала с расплавленным и остуженным питательным агаром в колбе или пробирке. После этого агар разливают в чашки Петри и инкубируют в термостате.
Разделение бактерий с использованием физических и химических факторов осуществляют следующим образом. Для выделения спорообразующих бактерий уничтожают неспорообразую-щие, прогревая исследуемый материал при 80 "С в течение 20 мин или подвергают кратковременному кипячению. Споры бактерий при этом сохраняются и при посеве прогретого материала на питательную среду прорастают. Если материал содержал только один вид спорообразующих бактерий, таким образом можно получить ЧК. Если материал содержал споры разных бактерий, дальнейшее выделение осуществляют стандартными методами.
При выделении ЧК психрофильных бактерий используют инкубацию при низких температурах, задерживающих рост сопутствующей микрофлоры. Так, например, для выделения ЧК возбудителя чумы {Yersinia pestis) посевы инкубируют при температуре около 5"С.
В ряде случаев ЧК бактерий можно получить путем подавления размножения части микробов в исследуемом материале воздействием на них факторами, к которым выделяемый вид устойчив. С этой целью используют антимикробные препараты, химические вещества и бактериофаги. В питательную среду вносят соответствующее вещество или фаг в строго определенной концентрации, препятствующей размножению сопутствующих бактерий, но не оказывающей выраженного ингибиру-ющего действия на исследуемый микроорганизм.
Кроме упомянутых, в бактериологической практике иногда применяют и другие методы. Например, для выделения чистой
 |
культуры бактерий рода Proteus (Proteus vulgaris) используют его способность к "ползучему" росту (метод Шукевича). При этом бактерии, засеянные в основание скошенного агара, за время культивирования распространяются по всей поверхности агара.
II этап — накопление ЧК для ее дальнейшей идентификации. II этап начинают с оценки результатов первичного посева материала и изучения кулыпуралъных признаков выросших бактерий — особенностей их роста на питательных средах.
Морфология микробных колоний является наиболее информативным культуральным признаком. Колонии различаются по величине, форме, цвету, консистенции, контуру края, структуре и характеру поверхности (рис. 3.1.1). По величине колонии могут быть крупные (диаметр более 4—5 мм), средние (2—4 мм) и малые (1—2 мм), по форме — круглые, розеткооб-разные, листовидные и т.д. Цвет колонии зависит от выработки определенного пигмента — белого, желтого, красного и др. Колонии непигментирующих бактерий бесцветны. По консистенции различаются сухие, влажные, сочные или слизистые колонии. Поверхность колонии бывает гладкой, морщинистой, исчерченной, плоской, выпуклой, вдавленной. Край колонии может быть ровным, волнистым, бахромчатым. Колонии могут иметь аморфную, зернистую, волокнистую внутреннюю структуру.
При получении микробного газона характер роста бактерий может быть сухим, влажным, "ползучим", складчатым, пигментированным. В жидкой питательной среде одни бактерии дают диффузное помутнение, другие характеризуются придонным или пристеночным ростом; некоторые культуры образуют пленки на поверхности среды, другие — осадок на дне пробирки, что преимущественно определяется потребностью в кислороде.
Для оценки результатов первичного посева исследуемого материала чашки с посевами просматривают и изучают морфологию выросших колоний. Для определения морфологии бактерий и их тинкториальных свойств из материала колоний разных типов готовят мазки, окрашивают по методу Грама и микроскопируют. Необходимо помнить, что родственные бактерии могут отличаться по морфологии колоний и наоборот. Материал из изолированной колонии каждого типа пересевают в отдельные пробирки со скошенным агаром или какой-либо другой питательной средой. Для этого часть колонии снимают петлей, не задевая соседние колонии, и засевают штрихом на скошенную поверхность агара в пробирку. Для выделения и накопления чистой культуры выбирают колонии только тех бактерий, которые присутствовали в исследуемом материале. Появление колоний других бактерий может быть результатом контаминации (загрязнения) посева посторонними микробами
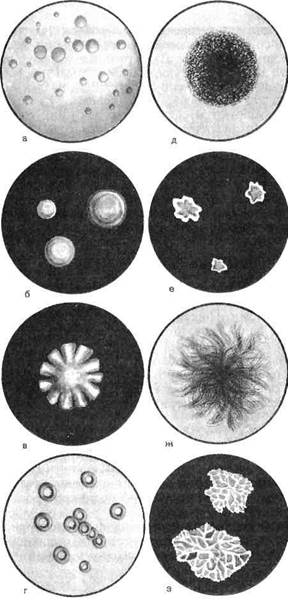
Рис.3.1.1. Типы бактериальных колоний, а — круглые с ровными краями; б — круглые, выпуклые, блестящие, слизистой консистенции; в — с неровными краями; г — круглые с валиком по периферии; Д — зернистые; е — плоские листовидные; ж — ветвистые; з — складчатые.

 вследствие недостаточно строгого соблюдения стерильных условий работы.
вследствие недостаточно строгого соблюдения стерильных условий работы.
Особенности культивирования анаэробных бактерий.Все манипуляции со строгими анаэробами должны осуществляться в бескислородных условиях. Для этого используют герметичные настольные камеры с регулируемым газовым составом среды. Посевы производят на специальные обогатительные (элективные) среды для анаэробов (тиогликолевую, Китта—Тароцци). Посевы инкубируют в специальных С02-инкубаторах или в анаэростатах (металлических или пластмассовых контейнерах, герметично закрывающихся крышкой, снабженной патрубками для заполнения газовой смесью нужного состава), которые помещают в обычный термостат. Для инкубации небольших по объему посевов (1—2 чашки Петри) применяют пластиковые пакеты, содержащие химические генераторы газовой смеси, которые обеспечивают полное удаление кислорода из воздушной среды в течение нескольких минут.
