Состав вещества и химические системы
Во тьме должны обращаться физики, а особливо химики, не зная внутренних, нечувствительных частиц строения.
М. В. Ломоносов
В настоящее время химическим элементомназывают вещество, все атомы которого обладают одинаковым зарядом ядра,
хотя и различаются по своей массе, вследствие чего атомные веса элементов не выражаются целыми числами.
Молекулойпо-прежнему называют наименьшую частицу вещества, которая определяет его свойства и может существовать самостоятельно. Однако к молекулам теперь относят также разнообразные другие квантово-механические системы (ионные, атомные монокристаллы, полимеры и другие макромолекулы). Последнее особенно важно для ясного понимания структуры с точки зрения системного подхода, где под структуройподразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные ее свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы.
Химия изучает процессы превращения молекул при взаимодействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного поля), во время которых образуются новые химические связи. Под химической связьюпонимается результат взаимодействия между атомами, выражающийся в создании определенной конфигурации атомов, отличающий один тип молекулы от другого. Химические связи порождают взаимодействие электронных оболочек атомов. Если атомные конфигурации подходят друг к другу, возникает одна округлая структура, несколько большая, чем до этого был каждый атом в отдельности. Так получается насыщенная молекула, и присоединить к ней еще какой-то атом почти невозможно, т. е. химические связи отличаются насыщенностью. С введением понятия валентности ею стали объяснять строение и химические свойства молекул. Наиболее распространены четыре вида химических связей: ионная, ковалентная, металлическая и водородная. Химическая связь, осуществляемая за счет образования общих для взаимодействующих атомов электронных пар, называется ковалентной связью. Химическая связь, в основе которой лежит электростатическое взаимодействие ионов, называется ионной.Химическая связь, основанная на обобществлении валентных электронов всех атомов в кристалле, называется
металлической.Химическая связь, обусловленная взаимодействием полярных молекул, одной из которых является водород, называется водородной.Химические связи можно рассматривать с точки зрения превращения энергии: если при создании молекулы ее энергия меньше, чем сумма энергий составляющих ее изолированных атомов, то она может существовать, т. е. ее связь устойчива.
Каждое вещество характеризуется определенными физическими и химическими свойствами. Когда какое-нибудь простое вещество вступает в химическую реакцию и образует новое вещество, то оно при этом теряет большинство своих свойств. Например, железо, соединяясь с серой, теряет металлический блеск, ковкость, магнитные свойства и др. Следовательно, в сульфиде железа нет железа, каким мы знаем его в виде простого вещества. Но так как из сульфида железа (FeS) при помощи химических реакций можно снова получить металлическое железо, то говорят что в состав сульфида железа входит элемент железо, понимая под этим тот материал, из которого состоит металлическое железо. Точно так же водород (Н) и кислород (О), входящие в состав воды, содержатся в воде не в виде газообразных водорода и кислорода с их характерными свойствами, а в виде элементов — водорода и кислорода. Если же элементы находятся в "свободном состоянии", т. е. не связаны химически ни с каким другим элементом, то они образуют простые вещества.
Долгое время не делалось различия между элементом и простым веществом. Понятие "элемент" в качестве научного термина впервые использовано Р. Бойлем в 1661 г. Со времен Бойля элементом считали всякое простое вещество, которое можно получить в результате разложения сложных веществ, но которое не способно к дальнейшему разложению на еще более простые вещества.
Также была опровергнута флогистонная теория окисления металла многочисленными экспериментами М. В. Ломоносова. Согласно этой теории процесс окисления металла рассматривался как реакция разложения: металл считался сложным веществом, а окалина простым, т. е. железо —» окалина + флогистон.
М. В. Ломоносов, проведя эксперименты в запаянных ретортах, установил, что масса сосуда с прокаленным железом не меняется, если взвесить, не вскрывая его. Французский ученый А. Лавуазье также показал, что горение есть реакция соединения вещества с кислородом воздуха. Лавуазье поставил на ноги всю химию, которая в своей флогистонной форме стояла на голове.
Начало XIX в. ознаменовалось открытием новых количественных закономерностей. Разработка атомно-молекулярной теории позволила Дальтону высказать атомную гипотезу и ввести в химию понятие об относительном атомном весе элементов и определить атомные веса некоторых элементов. По Дальтону, элемент можно определить как вид атомов, характеризующихся определенным значением атомного веса, а простые вещества состоят из определенного вида атомов, следовательно, простые вещества суть элементы. Путаница была устранена позже, когда было установлено, что многие простые вещества образованы из молекул, а не из атомов. Впервые Менделеев в связи с этим указал на необходимость ясно различать два понятия: элемент и простое вещество, или простое тело. Если простому веществу (телу) соответствует понятие о частице, то элементу — об атоме. Углерод есть элемент, а уголь, графит и алмаз суть тела простые.
Пользуясь понятием о химических элементах, можно сказать, что важнейшая задача химии состоит в изучении свойств элементов в отыскании общих закономерностей в их поведении и в отношении между собой. К середине XIX в. насчитывалось уже 63 элемента и был накоплен достаточно богатый экспериментальный материал, касающийся их физических и химических свойств, и были установлены групповые общие свойства. Были накоплены сведения и о таких характеристиках, как атомная масса элементов и их валентность, т. е. способность образовывать различные формы соединений. Прежде всего нужно было решить основной вопрос: являются ли химические элементы разрозненными, независимыми или они закономерно связаны между собой в единую систему.
Первые попытки решения этой задачи относятся к первой половине XIX в. Деберейнер (1829 г.) сгруппировал элементы в триады; Одлинг (1857 г.) разместил 48 элементов в единую таблицу из 13 групп сходственных элементов; Ньюлендс и де Шаркунтуа (1863 г.) распределили 63 элемента в порядке возрастания их атомной массы, была опубликована немецким химиком Л. Мейером таблица элементов, в которой отсутствовали бор, алюминий и водород. Всего попыток классификации было не менее пятидесяти, и все были по существу безуспешны. В основе неудач лежал метафизический способ их мышления. Наконец в 1869 г. Д. И. Менделеев предложил периодическую систематизацию свойств элементов.
Диалектико-материалистический подход к систематизации элементов является основной причиной успеха Д. И. Менделеева. Периодическая система элементов оказала большое влияние на последующее развитие химии, она явилась могучим орудием для дальнейших исследований. На основании периодического закона Д. И. Менделеев предсказал существование 12 новых элементов, причем для трех из них (галий — Ga, германий — Ge и скандий — Sc) описал подробно их свойства. В течение полувека были обнаружены в природе почти все элементы, расположенные до урана. Путеводной нитью для поиска и установления химической природы элементов явился периодический закон и метод предсказания, использованный Д. И. Менделеевым. Периодический закон и периодическая система получили свое полное подтверждение и дальнейшее развитие при установлении строения атомов элементов. Сейчас фактические данные в химии выросли в тысячи раз. Имеются сведения о 8 миллионах индивидуальных химических соединений постоянного состава и миллиардах соединений переменного состава.
Современная формулировка периодического закона следующая: от величины положительного заряда ядра атома зависят все свойства элемента и его положение в периодической системе. Теория строения атома объясняет периодическое изменение свойств элементов при переходе от одного периода к другому: с ростом Z строение электронных оболочек атомов повторяется.
Особенно это касается внешних энергетических уровней, на которых расположены валентные электроны. В пределах одного периода с увеличением заряда ядра наружные слои заполняются постепенно, достигая своей завершенности в атомах благородных газов. Эта последовательность повторяется в каждом периоде, вследствие чего в них наблюдается переход от металлов в начале периода к неметаллам и благородному газу в его конце. В свете теории строения атома периодический закон получил современную формулировку: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома.
Атомный вес элемента определяется как среднее арифметическое величин масс изотопов, из которых состоит элемент. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называют изотопами. Например, хлор состоит из двух изотопов с массовыми числами на 75,53% из изотопа 35Сl и на 24,47% — из 37Сl, в результате средняя атомная масса хлора равна 35,453. Открытие изотопов потребовало пересмотра понятия "химический элемент". Химический элемент — это вид атомов, характеризующийся определенной величиной положительного заряда ядра. Существование химического элемента в виде нескольких простых веществ называется аллотропией. Графит, алмаз, уголь — аллотропные видоизменения элемента углерода.
С развитием количественных методов исследования в химии были накоплены экспериментальные факты, обобщение которых привело к открытию так называемых стехиометрических законов — закона постоянства состава, закона эквивалентов и закона кратных отношений. Именно эти законы способствовали окончательному утверждению в химии атомно-молекулярного учения. Основой химической науки являются атомно-молекулярное учение, закон сохранения материи, периодический закон Д. И. Менделеева и теория химического строения.
Основные положения атомно-молекулярного учения заключаются в следующем:
1. Вещества состоят из молекул; молекулы различных веществ отличаются между собой химическим составом, размерами, физическими и химическими свойствами.
2. Молекулы находятся в непрерывном движении; между ними существует взаимное притяжение и отталкивание. Скорость движения молекул зависит от агрегатного состояния веществ.
3. При физических явлениях состав молекул остается неизменным, при химических — они претерпевают качественные и количественные изменения и из одних молекул образуются другие.
4. Молекулы состоят из атомов. Атомы характеризуются определенными размерами и массой. Свойства атомов одного и того же элемента одинаковы и отличаются от свойств атомов других элементов.
Масса атома, выраженная в атомных единицах массы (а.е.м.), называется относительной атомной массой. 1 а.е.м. = = 1,667 10-27кг.
Элементы, соединяясь в разных количественных соотношениях друг с другом, образуют химические соединения — сложные вещества. Что собой представляет химическое соединение? Обладает ли сложное вещество переменным или постоянным составом?
Известный французский химик Ж. Пруст в отличие от К. Бертолле считал, что любое химически чистое соединение независимо от способа его получения имеет вполне определенный состав. Именно на этом законе, получившем название закона постоянства состава,Ж. Пруст объяснил различие между химическими соединениями и смесями. Например СO2 (углекислый газ) можно получить несколькими способами:
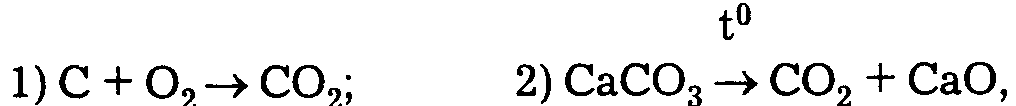
но в чистом СO2 всегда содержится 27,29% С и 72,71% O2 по массе.
Многие элементы, соединяясь друг с другом, могут образовывать разные вещества, каждое из которых характеризуется
определенным соотношением между массами этих элементов. Так, углерод и кислород образуют оксид углерода — СО и С02—диоксид углерода. Изучая подобные соединения, английский ученый Д. Дальтон, установил закон кратных отношений:если два элемента образуют друг с другом несколько соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие числа.
Дальтон придерживался атомной теории строения вещества; изучая свойства газов, открыл закон парциальных давлений газов. Закон непосредственно свидетельствовал о том, что элементы входят в состав соединений лишь определенными порциями, что свидетельствует о прерывном строении вещества. Развивая атомно-молекулярную теорию, Дальтон ввел близкое к современному представление об атомах и об относительных атомных массах элементов. Но в отличие от закона сохранения массы, справедливость которого полностью подтверждена открытиями, сделанными после его установления, законы постоянства состава и кратных отношений оказались не столь всеобщими. В связи с открытием изотопов выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. Например, тяжелая вода содержит 20% (масс) водорода, а обычная вода лишь 11%.
В начале XX в. (более чем через 100 лет) русский ученый Н. С. Курнаков, изучая сплавы металлов, открыл соединения переменного состава, в которых на единицу массы данного элемента может приходиться различная масса другого элемента. Для многих соединений переменного состава установлены пределы, в которых может изменяться их состав, и формула TiO2 более точно выражает свой состав в виде TiO1.9_2.0. Конечно, такого рода формулы указывают не состав молекулы (вещества имеют атомную структуру), а лишь отражают границы состава вещества. Периодическая система представляет пример упорядоченного конечного счетного множества химических элементов. А можно ли подобным образом упорядочить множество химических соединений, число которых хоть и велико, но не безгранично? И вот
оказалось, что вещества с одинаковыми суммами атомных номеров, молекулярных масс и плотностями обладают чрезвычайно близкими физико-химическими свойствами. Достаточно знать химический состав вещества и его плотность, чтобы предсказать и все его прочие свойства. Н. С. Курнаков предложил назвать соединения бертоллоидами в честь К. Бертолле, который впервые предсказал существование веществ переменного состава.
Таким образом, существует обширный класс соединений, не подчиняющихся стехиометрическим соединениям, законам, т. е. нарушение законов связано с вполне определенным агрегатным состоянием вещества.
В принципе, нет четкой границы между соединениями постоянного и переменного состава с точки зрения современной физики. Соединение может быть образовано и из атомов одного химического элемента — простое вещество. Сложное вещество образовано из атомов различной природы, т. е. в состав молекулы сложных веществ входят различные элементы. Вода образована атомами водорода и кислорода, а вещество кислород только из молекул одного элемента — кислорода. Но один элемент кислород образует два аллотропных видоизменения простых веществ кислород и озон, которые отличаются строением, структурой, физическими и химическими свойствами.
